МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для выполнения лабораторной работы по физической химии «Закон распределения. Жидкостная экстракция»
Страница 4 из 5
Цель работы: Определить количество извлеченного вещества при однократном и многократном извлечении одним и тем же объемом растворителя в системе I2/(/Н2О – бензол).
Оборудование и реактивы:
0,05 раствор I2 в бензоле; 0,01 Н Na2S2O3 для титрования.
Делительные воронки (100 мл) – 2 шт.; колбы с притертыми пробками – 4 шт.
Встряхиватель. Бюретка. Конические колбы для титрования.
Ход работы:
1. Приготовить 0,05 Н раствор I2 в бензоле.
2. Налить в две делительные воронки по 5 мл этого раствора.
3. В 1-ю воронку добавить 45 мл, а во вторую 15 мл дистиллированной воды.
4. Интенсивно встряхивать 30 минут и затем отстоять до полного расслаивания.
5. Слить водные растворы в колбы..
6. Во вторую воронку добавить еще 15 мл воды. Повторить операции (4), (5).
7. Повторить операцию (6).
8. Слить все водные (растворы) фазы после дробной экстракции в одну колбу.
9. Определить концентрацию равновесных водных и бензольных слоев титрованием 0,01Н Na2S2O3.
10. Рассчитать количество оставшегося вещества в органической фазе после экстракции:
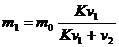 и
и 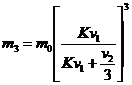
11. Рассчитать коэффициент распределения:
12. Сравнить результаты. Сделать вывод об оптимальном условии экстрагирования.
III. ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ. ВАРИАНТЫ I – VIII.
Вариант 1. 1. Вычислить среднее значение коэффициента распределения хинона между водой и этиловым эфиром при 19,5 Со, если концентрация хинона (моль/л) в воде 0,002915 и 0,008415, а в этиловом эфире соответственно 0,00893 и 0,02714.
2. Коэффициент распределения йода между водой и сероуглеродом (CS2) 0,0017. Водный раствор, содержащий 0,2 г/л йода? взболтали с 60 см3 CS2. Определить степень извлечения йода (%):
А) при однократном извлечении всей порцией сероуглерода;
Б) при трехкратном взбалтывании порциями по 20 см3 CS2.
Йод имеет нормальную молярную массу в обеих реакциях.
Вариант 2. 1. Концентрация янтарной кислоты (г/л): в воде 43,4; 43,8; 47,4, а в эфире соответственно 7,1; 7,4; и 7,9.
Показать, что для янтарной кислоты и указанных растворителей применим закон распределения в простейшей форме.
2. Коэффициент распределения нормальной масляной кислоты (С3Н8СООН) между хлороформом и водой С(СНСl3)/С(Н2О)=0,52 при 25 Со. Какое количество масляной кислоты можно извлечь из 100 см3 0,5 Н раствора масляной кислоты в хлороформе:
А) при встряхивании его однократно со 100 см3 Н2О;
Б) при четырехкратном встряхивании, используя каждый раз по 25 см3 воды?
Вариант 3. 1. Концентрация янтарной кислоты (г/л) в воде 12,1 при 15 Со. Водный раствор кислоты находится в равновесии с эфирным раствором, содержащим 2,2 г/л янтарной кислоты. Определите концентрацию эфирного раствора (г/л), который находится в равновесии с водным раствором, содержащим 9,68 г/л янтарной кислоты. Кислота имеет нормальную молекулярную массу в обоих растворителях.
2. Коэффициент распределения молочной кислоты (СН3 – СНOH – СООН) при 25 Со между хлороформом и водой С(СНСl3)/С(Н2О) = 0,0203. Какое количество молочной кислоты можно извлечь из 100 см3 0,8 М молочной кислоты в хлороформе 100 см3 Н2О?