МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 10 из 16
Упражнение №1. Вычислите потенциал металлического электрода, погруженного в раствор собственной соли по уравнению Нернста:
1.1. Цинкового электрода, погруженного в 150 мл раствора, содержащего 0,2 г сульфата цинка. (γ± ≈ 1).
1.2. Алюминиевого электрода, погруженного в 120 мл раствора, содержащего 0,1 г хлорида алюминия (γ± ≈ 1).
1.3. Свинцового электрода, погруженного в 200 мл раствора, содержащего 0,1г нитрата свинца (γ± ≈ 1).
Упражнение № 2.Вычислить ЭДС гальванического элемента при стандартных условиях, образованного:
2.1. Цинковым электродом, погруженным в 0,05 m раствор сульфата цинка и медным, погруженным в 0,02 m раствор сульфата меди.
2.2. Серебряным электродом, погруженным в 0,005 m раствор нитрата серебра и никелевым, погруженным в 0,1 m раствор сульфата никеля.
2.3. Кадмиевым электродом, погруженным в 0,1 m раствор сульфата кадмия и цинковым, погруженным в 0,02 m раствор сульфата цинка.
(Значения коэффициентов активности и стандартных электродных потенциалов найти в справочнике. Приложение, табл. 3, Справочник физико-химических величин [6])
Одной из разновидностей гальванических элементов является Концентрационный элемент, где необходимая для работы разность потенциалов достигается за счет использования одного и того же металла, погруженного в растворы солей с различной концентрацией. Электрод, помещенный в разбавленный раствор, при этом растворяется (является анодом), а на электроде, находящемся в концентрированном растворе, ионы металла осаждаются (является катодом). ЭДС концентрационного элемента можно рассчитать по формуле:
ЭДС =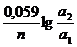
 (2.2.3)
(2.2.3)
При этом а2 > а1.
Упражнение №3. Вычислить при стандартных условиях ЭДС концентрационного гальванического элемента, состоящего из:
3.1. Цинковых электродов, погруженных в 0,5 и 0,05 m растворы сульфата цинка.
3.2. Серебряных электродов, погруженных в 0,5 и 0,05 m растворы нитрата серебра.
Значения активностей ионов в растворах заданной моляльности взять в приложении (табл. 3.3.).
Для потенциометрического определения концентрации водородных ионов или рН раствора используется водородная цепь:
(-)Pt, H2 | 2H+ ([H+]2) || 2H+([H+]1) | H2,Pt(+)
рН2 рН1
При [H+]1>[H+]2, т. е. рН 2 > рН1, в стандартных условиях ЭДС можно рассчитать по формуле:
ЭДС = 0,059 lg а(Н+)1/ а(Н+)2 (2.2.4)
Или для разбавленных растворов по формуле:
ЭДС = 0,059 lg [H+]1/[H+]2 (2.2.5)
Для разбавленных растворов электролитов в стандартных условиях Е(2Н+/Н2) = - 0,059 рН и ЭДС может быть рассчитана по формуле:
ЭДС =0,059 (рН2 – рН1) (2.2.6)
Упражнение №4. А) Определите величину потенциала водородного электрода, при значениях [H+] моль/л: 0,1 0,01, 0,001, 0,0001 и 0,00001.
Б) В каком направлении пойдет ток в элементе, состоящем из водородных электродов, находящихся в растворах с рН = 2 и рН = 13?
2.2.2. Произведение растворимости соли и ЭДС
Если в окислительно – восстановительной реакции образуется малорастворимое соединение, то согласно уравнению Нернста, в процессе уменьшения концентрации ионов металла в растворе восстановительный потенциал системы резко возрастает. Например, металлическое серебро может вытеснять водород из йодоводородной кислоты:
2Ag + 2 HI = 2 AgI↓ + H2↑
ПР(AgI) = 1,5 10-16. Если концентрация кислоты 1 моль/л, то и [I-] = 1 моль/л, из выражения произведения растворимости [Ag+] = 1,5 10-16 моль/л, тогда
Е = Е0 + 0,059 lg [Ag+] = 0,80 + 0,059 lg 1,5 10-16 = - 0,134 В. При таких условиях серебро в ряду напряжений стоит до водорода и может вытеснять его из кислоты.
Упражнение №5. Вычислите потенциал серебряного электрода, погруженного в насыщенный раствор:
5.1. Хлорида серебра (ПР = 8,3 10-10). При какой концентрации ионов серебра Е = 0?
5.2. Сульфида серебра (ПР = 6,3 10-50). Во сколько раз надо изменить (повысить или понизить) активность ионов серебра, чтобы потенциал электрода был равен нулю?
5.3. Вычислите ПР(AgI) при стандартных условиях, если потенциал серебряного электрода, погруженного в насыщенный раствор AgI, равен 325 мВ относительно водородного электрода.
Одна из областей применения электрохимии – потенциометрическое