Лекция Кинетическая теория газов и основные газовые законы
Страница 4 из 6
Состав газовых смесей может быть выражен:
а) массовыми долями: 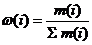
 (3.2)
(3.2)
б) мольными (молярными) долями: 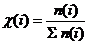 (3.3)
(3.3)
в) Объёмными долями: 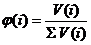 (3.4)
(3.4)
Т. к. V=Vm × n, где Vm - молярный объём газа при заданных условиях, то
φ (і) = χ (і)
Общее давление газов в смеси по закону Дальтона Р = Σрі, поэтому парциальное давление газа в смеси можно рассчитать по формуле:
Рі = φіּР(общ.) (3.5)
Если известны массы газов в смеси и температура смеси, то общее давление рассчитывают по уравнению состояния идеального газа.
Пример 3. В закрытом сосуде ёмкостью 3 л смешаны 0,5 л азота с начальным давлением 103,5 кПа и 2,5 л водорода с начальным давлением 93,7 кПа. Определить парциальные давления газов и общее давление смеси.
Решение:
После смешивания давление каждого газа в смеси (парциальное давление) по сравнению с исходным давлением уменьшится во столько раз, во сколько увеличивается объём, занимаемый газом:
РN2парц=0,5/3 103,5 кПа = 17,25 кПа;
РН2парц.=2,5/3 93,7 кПа = 78,08 кПа.
По закону Дальтона общее давление есть сумма парциальных давлений:
Робщ=РN2парц + РH2парц= 95,33 кПа
Пример 4. В баллоне вместимостью 20 л при 180С находится смесь из 28 г кислорода и 24 г аммиака. Определить парциальные давления каждого из газов и общее давление смеси.
Решение:
Общее давление газовой смеси можно рассчитать по уравнению Менделеева - Клапейрона: РV= nRT, где n - суммарное количество вещества в газовой смеси. Для нахождения n необходимо рассчитать количество О2 и NH3 : n=m/м
Парциальное давление газов в смеси пропорционально их объёмной доле в смеси φ или мольной доле χ:
φ(O2) = n(O2)/n, φ(NH3) = n(NH3)/n:
Решение удобно оформить в виде таблицы:
|
M, г
|
М,
Г/моль
|
Ni = mi/Мi
|
φ i=ni/n
|
Piпарц =
φi Р(общ.)
|
|
О2
|
28
|
32
|
0.88
|
0,38
|
103
|
|
NH3
|
24
|
17
|
1.41
|
0,62
|
168
|
|
Газовая смесь
|
|
|
2,29
|
1,00
|
271*)
|
*) Р(общ.) = n(общ.) RT/V(общ.) = 2,29 8,314 291/0,02 = 271 кПа
Парциальные давления газов в смеси необходимо учитывать при проведении экспериментов с газами. Так, например, если газ собран над жидкостью, то при расчётах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси и парциального давления пара жидкости.
Р(газ) = Р(общ.) – Р(пара)
ПРИМЕР 5. Какой объём займут при н. у. 120 мл N2 , собранного над водой при 20ºС и Р = 100 кПа (750мм рт. ст.), если Р²º(Н2О) = 2,3 кПа.
Решение:
Р(N2) = Р(общ.) – Р(Н2О) = 100 - 2,3 = 97,7 кПа
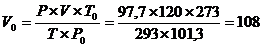 Мл
Мл
.
Задачи для самостоятельного решения
3.1 Вычислить объёмные доли (φ,%) неона и аргона в смеси, если их парциальные давления составляют соответственно 203,4 и 24,6 кПа.
3.2 Общее давление смеси аргона и водорода составляет 108,6 кПа. Какова объёмная доля аргона, если парциальное давление водорода 105,2 кПа?
3.3 Газовая смесь приготовлена из 3 л метана при давлении 95940 Па, 4 л водорода при давлении 83950 Па и 1 л оксида углерода (ІV) при давлении 108700 Па. Объём смеси 8 л, Определить парциальные давления газов в смеси и общее давление.
3.4 Смешивают 3 л азота, находящегося под давлением 95940 Па с 2 л кислорода. Объём смеси 5 л, общее давление 104200 Па. Под каким давлением был введён кислород?
3.5 Два баллона с кислородом вместимостью 3 и 4 л соединены между собой трубкой с краном. При закрытом кране давление кислорода в первом баллоне равно 55970 Па, а во втором - 103500 Па. Температура газа одинакова. Каким станет давление в баллонах при той же температуре если открыть кран? Объёмом трубки пренебречь.
3.6 Сосуд объёмом 3,2 л разделён пополам полупроницаемой перегородкой. В одну половину сосуда введены 2,4 г водорода и 30 г азота, а другой половине - вакуум. Через перегородку может диффундировать только водород. Во время процесса поддерживается Т = 1000 C. Какие давления установятся в обеих частях сосуда после установления равновесия?
3.7 В сосуде объёмом 4000 л при Т = 27 0 C находится смесь из 3 кг СО2, 1 кг N2 и 9 кг СО. Вычислить парциальные давления газов, образующих смесь и общее давление смеси.
3.8 В газометре над водой при температуре 250С находится 5,2 л О2 под давлением 102,4 кПа. Каков объём сухого кислорода, если Р(Н2О)25 = 3,164 кПа?
3.9 1 л сухого газа при н. у. имеет массу 2 г. Какова масса 1 л влажного газа в этих условиях?
3.10 Над водой при 27оС и Р = 100 кПа собрано 450 мл водорода. Найти объем сухого водорода при нормальных условиях.
3.2 . Молекулярная масса газовой смеси. Пересчёт состава газовой смеси из объёмных долей в массовые и наоборот
Для расчёта средней молекулярной массы газовой смеси используют правила смешения:
а) Через массовые доли (ω):
М(смеси) = 1/Σ ωi/Мi
или М(смеси) = 1/Σ ni (3.6)