Лекция Кинетическая теория газов и основные газовые законы
Страница 2 из 6
Д) повышение давления с ростом температуры?
3. Правильно ли утверждение, что в 22,4 л любой смеси газов при нормальных условиях содержится 6,02·10²³ молекул?
4. Что такое универсальная газовая постоянная и каков её физический смысл? Приведите численные значения R при различных способах выражения P и V.
5. Во сколько раз увеличивается объём воды при переходе из жидкого состояния в газообразное при нормальных условиях?
6. Что тяжелее: сухой или влажный газ? Имеет ли значение то, о каком газе идёт речь? (приведите примеры)
7. Студент выразил убеждение, что при одинаковых физических условиях значения относительной плотности по воздуху в группах веществ а) - е) будут равными, поскольку эти вещества состоят из атомов одинаковых элементов. Прав ли студент?
А) Cl2O, ClO2, Cl2O7;
Б) S2Cl2, SCl2, SCl4;
В) N2O, NO2, N2O4;
Г) CH4, C2H2, C2H4;
Д) P2F4, PF3, PF5;
Е) NH2Cl, NH4Cl, N2H6Cl2;
Задачи для самостоятельного решения
1.1 Давление газа, занимающего при некоторой температуре объём 0,3 м³, равно 101,5 кПа. Каким будет давление, если при той же температуре увеличить объём газа до 0,5 м³?
1.2 При 17ºС объём газа 440 л. Какой объём займёт тот же газ при 47ºС ( Р= const)?
1.3 В баллоне при 20ºС находится газ под давлением 4,053 МПа (40 атм.). Каким станет давлением, если температура повышается до 30ºС?
1.4 Приведите к нормальным условиям 608 л газа, имеющего температуру 91ºС и давление 98642 Па.
1.5 При 25ºС и 85312 Па газ занимает объём 820 мл. Вычислить объём газа при нормальных условиях.
1.6 Масса 1л газа (н. у.) составляет 1,25 г. Вычислите молекулярную массу газа.
1.7 Вычислите массу 0,25 л неона при 90ºС и 101308 Па.
1.8 Рассчитайте давление, оказываемое 1 кмоль СО2 при 500С, если он занимает объем 1м3 , по уравнениям Менделеева - Клайперона и Ван-дер-Ваальса. Сопоставьте полученные результаты.
1.9 По уравнению Ван-дер-Ваальса вычислите давление 1кмоль аммиака при 2000С, находящегося в сосуде вместимостью 500 л. На сколько (%) найденное давление отличается от вычисленного по уравнению состояния идеального газа?
1.10 По уравнению Ван-дер-Ваальса вычислите температуру, при которой объём 1 кмоль сероводорода под давлением 6,66 106 Па станет равным 500 л.
2. Способы определения молекулярной массы газообразных веществ
2.1. По плотности газообразного вещества.
Плотность газа 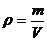 ; для 1моль газа при нормальных условиях m =М; V= 22,4 , л/моль; тогда
; для 1моль газа при нормальных условиях m =М; V= 22,4 , л/моль; тогда 
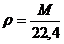 , г/л
, г/л
Пользуясь уравнением состояния идеального газа (1.5), можно записать:
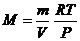 или
или 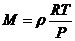 (2.1)
(2.1)
2.2. По относительной плотности газа
Из закона Авогадро следует, что массы двух одинаковых объёмов различных газов (при одинаковых Т и Р) будут относиться, как их молекулярные массы:
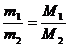 (2.2)
(2.2)
Отношение 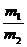 называется относительной плотностью первого газа по второму и обозначается D:
называется относительной плотностью первого газа по второму и обозначается D:
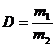 или
или 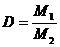 (2.3)
(2.3)
Следовательно, 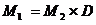 (2.4)
(2.4)
2.3. Эвдиометрический метод
Эвдиометрия- метод определения формулы газа по сжиганию в избытке кислорода и анализу конечных продуктов.