МЕТОДИЧЕСКИЕ УКАЗАНИЯ по выполнению лабораторно-практических занятий по дисциплине «Физическая и коллоидная химия» «Гетерогенные равновесия. Фазовые диаграммы температура кипения - состав для двухкомпонентных систем»
Страница 2 из 9
Число компонентов в растворах солей равно количеству ионов, образующих данную систему, без учета воды. Так, в равновесной системе:
KCl +NH4NO3↔KNO3+NH4Cl
К = 4(количество ионов) + 1(вода) – 1 уравнение
Число компонентов системы равно числу входящих в нее веществ минус число уравнений, связывающих концентрации этих веществ.
В гетерогенных системах возможны следующие процессы или явления:
1. Переходы веществ из одной фазы в другую или агрегатные превращения.
2. Растворение твердых веществ.
3. Перераспределение растворенного вещества между двумя растворителями.
4. Химические реакции.
Равновесию гетерогенных систем отвечает:
· равенство химических потенциалов каждого компонента во всех фазах (иначе будет происходить переток вещества);
· минимальное значение одного из термодинамических потенциалов (энергии Гиббса или энергии Гельмгольца);
· максимальное значение энтропии.
/На практике наиболее обычными условиями являются постоянство температуры и давления, поэтому равновесие в гетерогенных системах можно оценивать по их изобарно- изотермическому потенциалу или энергии Гиббса (ΔG = ΔH – TΔS)/.
Любая термодинамическая система может быть охарактеризована Вариантностью или числом степеней свободы V.
Вариантность – это число параметров системы, которые можно менять независимо, не меняя при этом числа и вида фаз системы.
Например, для описания состояния чистого газа необходимо знать 2 переменные – температуру и давление или давление и объем, так как третью переменную можно рассчитать по уравнению состояния идеального газа:
PV = nRT. Следовательно, чистый газ имеет число степеней свободы V = 2. Чистая жидкость или твердое вещество также имеют V = 2.
Равновесные гетерогенные системы, состоящие из любого числа фаз и любого числа веществ, подчиняются общей закономерности – Правилу фаз Гиббса(1876 г.):
Число степеней свободы равновесной термодинамической системы, на которую из внешних факторов влияют только температура и давление, равно числу компонентов минус число фаз плюс 2.
V = C – P + 2
Примечание 1. Если один из параметров (температура или давление) постоянен, то имеем дело с Условной вариантностью системы и V = C – P + 1.
Примечание 2. Если система определяется, кроме температуры и давления, еще одним параметром, например, величиной поверхностной энергии дисперсных частиц, то V = C – P + 3.
По величине числа степеней свободы или вариантности системы подразделяют на:
· инвариантные или нонвариантные, V = 0;
· моновариантные, V = 1;
· дивариантные, V = 2 и т. д.
2.2. Однокомпонентные системы. Диаграммы состояния
В однокомпонентных системах отдельные фазы представляют собой одно и то же вещество в различных агрегатных состояниях. Если вещество образует различные кристаллические модификации (аллотропы), то каждая из них является отдельной фазой, устойчивой в определенных интервалах температуры и давления. Для таких систем V = 1 – P + 2 = 3 – P. Одновременно сосуществующее число фаз может быть 1, 2, 3. То есть, Ни одно из индивидуальных веществ не может образовывать равновесную систему, состоящую более, чем из трех фаз! Этот вывод подтверждают все известные экспериментальные данные.
В общем случае нам неизвестен вид уравнений состояния различных фаз, поэтому единственной возможностью найти зависимость между значениями переменных, определяющих состояние системы, Остается метод непосредственных измерений температуры, давления, концентрации и объема компонентов равновесных систем. Полученные данные используются для построения Диаграмм состояния – графического выражения искомых закономерностей. Если на диаграмме состояния указаны фазы системы, то такая диаграмма называется Фазовой диаграммой.
Метод физико-химического анализа всегда приводит к диаграмме – геометрическому образу отношений состав – свойство системы. Химические диаграммы представляют собой геометрические фигуры – комплекс точек, линий, поверхностей, объемов. Исследование геометрических образов дает повод к раскрытию физико-химических связей. Так, именно геометрический метод позволил выделить общие свойства диаграмм – принципы непрерывности и соответствия (Н. С. Курнаков):
При непрерывном изменении параметров, выражающих состояние системы, свойства отдельных фаз ее изменяются непрерывно, свойства системы в целом изменяются также непрерывно при условии, что не возникают новые фазы и не исчезают старые.
Если на диаграммах появляются точки (минимумы, максимумы, точки перегиба, эвтонические), обладающие какой-либо особенностью по сравнению с соседними, их называют замечательными или сингулярными точками. Важнейшим свойством этих точек является то, что При изменении условий равновесия системы отвечающий им состав не меняется.
2.3. Двухкомпонентные системы. Диаграммы состав – свойство
В уравнениях состояния двухкомпонентных систем число переменных равно четырем: это температура, давление и концентрации обоих компонентов (Р, Т, С1, С2). Если концентрации компонентов выразить в массовых долях (ω) или мольных долях (χ), то число переменных сократится до трех. Состав бинарной смеси можно изобразить отрезком – осью состава (рис.2.1.)

Рис.2.1. Изображение бинарной смеси на оси состава.
По правилу рычага в произвольно взятой точке Х будет выполняться равенство: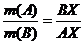 , если по оси состава отложены массовые доли, и
, если по оси состава отложены массовые доли, и 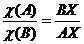 , если по оси состава отложены молярные доли.
, если по оси состава отложены молярные доли.