МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для выполнения лабораторной работы по физической химии «Закон распределения. Жидкостная экстракция»
Страница 1 из 5
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ для выполнения лабораторной работы по физической химии «Закон распределения. Жидкостная экстракция»
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
Студентам III курса технологического факультета
Для выполнения лабораторной работы
По физической химии на тему:
«Закон распределения. Жидкостная экстракция»
ЦЕЛЬ РАБОТЫ: изучение процесса жидкостной экстракции одного из основных процессов пищевых технологий.
ЗАДАЧА РАБОТЫ: приобретение практических навыков в проведении лабораторных исследований, обработке экспериментальных данных аналитическим и графическим методами.
ВВЕДЕНИЕ
Одним из частных случаев трехкомпонентных систем является следующий: две жидкости взаимно нерастворимы, а третий компонент способен растворяться и в одной и в другой. При достижении равновесия в системе происходит распределение третьего компонента между двумя несмешивающимися жидкими фазами в определенном соотношении, качественно характеризующемся константой распределения.
Наиболее известный пример применения закона распределения – экстрагирование, т. е. извлечение вещества из раствора подходящим растворителем, который не смешивается с первым и в то же время растворяет извлекаемое вещество в большем количестве, чем первый. Для многих органических веществ таким растворителем является эфир, а неорганических – вода. Для полноты извлечения экстрагируемое вещество переводят в то молекулярное состояние, в котором оно находится в обеих фазах. Так, например, при извлечении слабой органической кислоты выгодно понизить степень ее диссоциации добавлением минеральной кислоты. В этом случае недиссоциированные молекулы органической кислоты извлекаются полнее. Растворимость же органических веществ в воде существенно снижается в присутствии солей – эффект высаливания.
Экстракция – один из самых распространенных процессов в химической, фармацевтической, пищевой и других отраслях промышленности. Экстрагирование широко используется для извлечения эфирных масел из растительного сырья и их очистки. В виноделии процесс экстракции используется при получении сырья для производства вермутов, переработки виноградных жмыхов.
I. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1. Закон распределения.
Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно распределяется между ними в отношении, определяемом законом Нернста-Шилова:
Растворяемое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
K = C1/C2 (1), где С1 и С2 – концентрации вещества в 1-м и 2-м растворителях.
Закон выполняется при постоянной температуре, достаточном разбавлении растворов, при отсутствии взаимодействия растворенного вещества с растворителем.
В реальных условиях при растворении веществ происходят процессы ассоциации и диссоциации молекул растворяемого вещества.
Случай 1. Вещество ассоциировано в одном из растворителей за счет образования водородных связей с возникновением димеров:

 2А А2
2А А2
Или полимеров

 NА Аn
NА Аn
Закон распределения в этом случае будет выглядеть следующим образом:
К=С1N/C2 или 
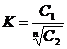 (2)
(2)
Здесь N=М1/М2 – отношение средних молекулярных масс вещества в одном и другом растворителях.
Если преобразовать уравнение (2), прологарифмировать его, получим
Lg K = n lg C1 – lg C2 или
Lg C2 = n lg C1 – lg K (3)
– это прямая зависимости Lg C2 = F(Lg C1)
Уравнение позволяет графически определять N и К из экспериментальных данных.
Случай 2. В одном из растворителей (чаще всего в воде) вещество диссоциировано, а в другом (органическом) ассоциировано.
Закон распределения принимает вид:
 (4)
(4)
A-степень диссоциации.
Пример 1. При распределении фенола между водой и бензолом получены следующие данные:
С1(Н2О), кмоль/дм3 0,0316 0,123 0,327 0,750
С2(С6Н6), кмоль/дм3 0,0077 0,159 0,253 0,390
Вычислить значение К и N графически.