МЕТОДИЧЕСКИЕ УКАЗАНИЯ По выполнению лабораторно-практических занятий и заданий для самостоятельных работ по дисциплине «Физическая и коллоидная химия»
Страница 8 из 11
2.5.1. Пользуясь правилом Траубе, найти, во сколько раз поверхностная активность амилового спирта больше, чем этилового.
2.5.2. Вычислите величину адсорбции пропилового спирта при 15оС из водного раствора с концентрацией 0,12 моль/л, если поверхностное натяжение воды при этой температуре равно 73,49 10-3 Н/м, а спирта 63,3 10-3 Н/м.
2.5.3. Вычислите длину молекулы масляной кислоты на поверхности раздела вода – воздух, если площадь, занимаемая одной молекулой в поверхностном слое, равна 3,2 10-19 м2, плотность кислоты 978 кг/м3.
2.5.4. Вычислите по уравнению Ленгмюра величину сорбции при 292 К для следующих концентраций изоамилового спирта (кмоль/м3): 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,7, если величина предельной сорбции равна 7,8 10-9 кмоль/м2. Постройте изотерму адсорбции.
2.5.5. Рассчитайте величину адсорбции по уравнению Гиббса для 0,1М органических кислот, если известна их поверхностная активность (м2/Н кмоль):
Пропионовая (-0,0 85), н-масляная (-0,29), н-валериановая (-0,89), н-капроновая (-2,4), н-гептановая (-7,6). Как на основе этих данных подтвердить верность правила Траубе - Дюкло?
3. Лабораторная работа №3
Изучение процесса адсорбции из растворов на поверхности раздела твердое тело – жидкость
3.1. Цель и задачи работы
Изучить особенности процесса адсорбции ПАВ из водных растворов на поверхности раздела твердое - жидкость.
Освоить приемы подготовки твердого адсорбента к работе: измельчение, классификация на наборе сит, квартование (отбор средней пробы), отмывка от примесей, сушка.
Исследовать процесс адсорбции уксусной кислоты на поверхности активированного угля.
Усвоить приемы обработки полученной в процессе постановки опыта информации графическим и аналитическим путем, определив константы в уравнении Фрейндлиха – Бедекера.
3.2. Основные сведения об адсорбции на границе твердое тело – жидкость
Рассмотрим один из случаев адсорбции на поверхности раздела твердое – газ для водных растворов неэлектролитов, так называемую Молекулярную адсорбцию. Этот вид адсорбции осложняется тем, что на поверхности адсорбента происходит жесткая конкуренция молекул растворителя и растворенного вещества за адсорбционные центры на поверхности твердого тела. Это, во – первых, осложняет адсорбцию и замедляет установление адсорбционного равновесия во – вторых, приводит к различным отклонениям изотерм адсорбции от их обычного вида (рис. 3.1).
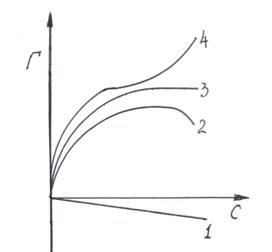
Изотерма (3) описывает традиционную мономолекулярную, а (4) - полимолекулярную адсорбции. Кажущееся уменьшение адсорбированного количества растворенного вещества при повышении его концентрации в растворе (2) связано с поглощением поверхностью адсорбента молекул растворителя. Кривая (1)
Рис. 3.1. Виды изотерм адсорбции растворенных веществ на поверхности твердых тел.
Соответствует случаю, когда растворитель поглощается намного лучше растворенного вещества.
На адсорбцию из раствора большое влияние оказывает химическая природа адсорбента, адсорбата и растворителя. Адсорбционные системы подчиняются Правилу уравнивания полярностей Ребиндера:
На поверхности раздела фаз с различными полярностями может адсорбироваться только вещество с промежуточной полярностью.
Мерой полярности вещества при этом может служить величина его диэлектрической проницаемости ε. В случае адсорбции из водных растворов дифильных органических соединений на твердых адсорбентах следует учитывать следующий ряд веществ, расположенных в порядке возрастания полярностей:
Уголь < Дифильное органическое вещество < Вода < Силикагель (глины)
Следовательно, если необходимо удалить дифильное вещество из водных растворов, следует применять уголь, если из органических растворителей - силикагель, который прочно удерживает воду. Следует отметить, что в случае адсорбции веществ дифильной природы из воды На гидрофобных адсорбентах выполняется правило Траубе – Дюкло. Если же адсорбция идет из малополярного растворителя происходит обращение правила Траубе – Дюкло, а именно: удлинение цепи на гомологическую разность - СН2- ведет к уменьшению адсорбции ПАВ, так как при этом уменьшается доступная для молекул площадь адсорбента. Количественно величина адсорбции определяется по разности концентраций растворенного вещества до (со) и после (ср) адсорбции:
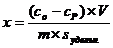 (3.1)
(3.1)
Зависимость величины адсорбции от равновесной концентрации растворенного вещества описывается следующими уравнениями:
Эмпирическим уравнением Фрейндлиха Бедекера:
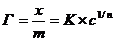 (3.2),
(3.2),
Где 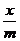 - величина адсорбции, приходящаяся на единицу веса адсорбента, с – равновесная концентрация. Фактически – это уравнение параболы. В отличие от изотермы Ленгмюра она не имеет площадки, отвечающей предельному насыщению монослоя адсорбированного ПАВ. Недостатком данного уравнения является то, что в области малых и больших концентраций значение адсорбции, вычисленное по уравнению, не соответствует экспериментальным данным. Кроме того, и это существенно, константы уравнения не имеют физического смысла.
- величина адсорбции, приходящаяся на единицу веса адсорбента, с – равновесная концентрация. Фактически – это уравнение параболы. В отличие от изотермы Ленгмюра она не имеет площадки, отвечающей предельному насыщению монослоя адсорбированного ПАВ. Недостатком данного уравнения является то, что в области малых и больших концентраций значение адсорбции, вычисленное по уравнению, не соответствует экспериментальным данным. Кроме того, и это существенно, константы уравнения не имеют физического смысла.