МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 8 из 16
1.4.3.Кондуктометрическое титрование раствора сильной кислоты сильным основанием
Ход работы:
1. В сосуд для титрования поместить 5 мл примерно 0,1 Н раствора исследуемой кислоты, разбавить дистиллированной водой настолько, чтобы кондуктометрическая ячейка была полностью погружена в раствор.
2. Измерить сопротивление исходного раствора.
3. Прилить из бюретки 0,2 мл 0,8 Н раствора едкого натра, перемешать раствор и вновь измерить сопротивление.
4. Операцию п.3 повторять до тех пор, пока не будет пройдена точка эквивалентности.
5. Результаты опыта занести в таблицу 1.2.
Таблица 1.2. Результаты кондуктометрического титрования
|
№ определения
|
Суммарный объем щелочи, мл
|
Сопротивление, R, Ом
|
Электропроводность
L = 1/R, См
|
|
1
|
0
|
|
|
|
2
|
0,2
|
|
|
|
3 …
|
0,4 …
|
|
|
Обработка результатов эксперимента
1. Построить график в координатах Электропроводность – Объем щелочи.
2. По величине минимальной электропроводности (точка пересечения прямых) найти эквивалентный объем щелочи.
3. Рассчитать нормальность раствора кислоты.
1.5. Контрольные задания
1.5.1. Тест по теме: «Электропроводность растворов»
|
№
|
|
Варианты ответа
|
|
А
|
Б
|
В
|
|
1
|
Автор:
А) теории электролитической диссоциации;
Б) закона независимости движения ионов;
В) закона разведения
|
Кольрауш
|
Оствальд
|
Сванте Аррениус
|
|
2
|
Математическое выражение закона:
А) разведения;
Б) Кольрауша;
В) действия масс применительно к процессу диссоциации
|
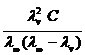
|
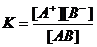
|
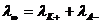
|
|
3
|
Процесс:
А) объединения химических частиц;
Б) Взаимодействия химических частиц с молекулами растворителя;
В) распада химических частиц
|
Сольватация
|
Диссоциация
|
Ассоциация
|
|
4
|
Размерность в системе СИ:
А) κ
Б) λ
В) L
|
См
|
См/м
|
См м2/моль
|
|
5
|
Условное обозначение физических величин:
А) удельная электропроводность;
Б) эквивалентная электропроводность;
В) электрическая проводимость
|
λ
|
|
 κ κ
|
|
6
|
Формула для расчета:
А) подвижности ионов;
Б) степени диссоциации слабых электролитов;
В) эквивалентной электропроводности
|
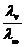
|
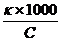
|
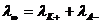
|
1.5.2. Банк Комбинированных задач.
1. Для эквивалентной электропроводности амида азотной кислоты, растворенного в воде при 15оС, были получены следующие данные:
|
С, моль/л
|
0,03
|
0,015
|
0,0075
|
0,00375
|
0,001875
|
|
λ, См см2/моль
|
1,017
|
1,446
|
2,052
|
2,89
|
4,053
|
λ∞(Н+) = 298; λ∞(Na+) =39,9; λ∞(NaHN2O2) = 93
Определите константу равновесия для диссоциации амида азотной кислоты в соответствии с уравнением: H2N2O2 → H+ + HN2O2-.