МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 6 из 16
Электропроводность раствора понижается по мере добавления к титруемому раствору кислоты раствора щелочи за счет связывания катионов водорода и гидроксид - анионов в малодиссоциированное соединение – воду (участок ab). В момент полной нейтрализации в растворе останутся только катионы натрия и хлорид–анионы λ∞(NaCl) = 43,3 + 65,3 = 108,6 См см2/моль – точка b. Дальнейшее прибавление щелочи ведет к повышению электропроводности (участок bc).
Б) слабая кислота + сильное основание:
CH3COOH + Na+ + OH - = CH3COO - + Na+ + H2O
На участке ab электропроводность раствора растет вследствие замещения малодиссоциированной кислоты ее солью. После достижения точки эквивалентности (точка b) электропроводность раствора растет еще больше за счет введения избыточных ионов ОН -
В) смесь слабой и сильной кислот + сильное основание:
На графике наблюдается три участка (ab, bc, cd). Первый соответствует титрованию сильной кислоты, второй – слабой, третий – избыточной щелочи.
Пример 6. Рассмотрите ход кривых кондуктометрического титрования на примере реакции осаждения, протекающей между растворами нитрата серебра и хлорида натрия.
Решение. При добавлении к раствору хлорида натрия небольших порций раствора нитрата серебра происходит падение электропроводности за счет связывания катионов серебра и хлорид-анионов в малорастворимую соль. Точка эквивалентности соответствует электропроводности раствора нитрата натрия: λ∞(NaNO3) = 43,5 +61,7 =195,2 См см2/моль.
Ag+ + NO3- + Na+ + Cl - = AgCl↓ + Na+ + NO3-. После прохождения точки эквивалентности электропроводность резко возрастает, так как подвижность ионов серебра превышает подвижность ионов натрия. (Приложение. Табл.1)
При кондуктометрическом титровании нет необходимости в определении константы сосуда и расчете электропроводности. Вместо последней на оси координат можно откладывать величину электрической проводимости L.
L = 1/R (см. раздел 1.2.1).
Пример 7. При кондуктометрическом титровании 25 мл соляной кислоты раствором 5н КОН были получены следующие результаты:
|
Объем КОН, мл
|
0,32
|
0,60
|
0,92
|
1,56
|
2,00
|
2,35
|
|
Удельная электропроводность, См/см
|
3,2
|
2,56
|
1,86
|
1,64
|
2,38
|
2,96
|
Определите нормальность кислоты.
Решение. Построим график в координатах κ – V(KOH). Спроектируем точку излома на ось объема и найдем эквивалентный объем щелочи, израсходованной на полную нейтрализацию кислоты, содержащейся в 25 мл исходного раствора. Рассчитаем эквивалентную концентрации соляной кислоты, воспользовавшись формулой: Сэ(НСl)×V(HCl) = Cэ (KOH)×V(KOH)
Ответ: V(KOH)= 1,24 мл; Сэ(НСl) = 0,248 моль/л
Задачи для самоподготовки
1.3.9. При титровании 25 мл соляной кислоты 1,5 Н раствором едкого натра получены следующие данные:
|
Объем щелочи, мл
|
0
|
4,5
|
6,25
|
10,0
|
|
κ, См/м
|
0,872
|
0,215
|
0,290
|
0,552
|
Определите нормальность соляной кислоты.
1.4. Экспериментальная часть
1.4.1. Измерение электрической проводимости. Определение постоянной сосуда
Для определения электролитической проводимости может использоваться Кондуктометрическая ячейка – стеклянный сосуд без дна с двумя электродами известной площади, прочно укрепленными на фиксированном расстоянии друг от друга. Электроды выполнены из платиновой черни. Ячейку погружают в раствор электролита. Сопротивление кондуктометрической ячейки измеряют при помощи мостика Уитсона (рис. 1.3.).
.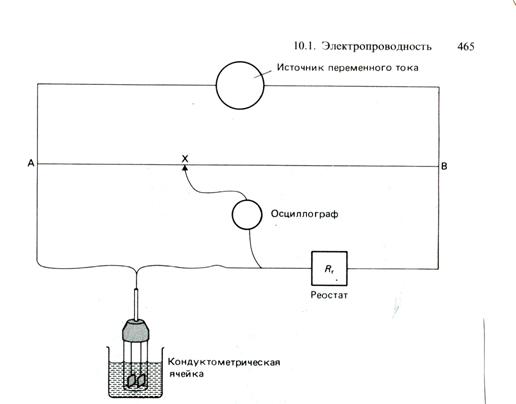
Рис. 1.3. Мостик Уитсона с кондуктометрической ячейкой.
Скользящий контакт перемещается по проволочному сопротивлению до тех пор, пока осциллограф не зарегистрирует минимальный сигнал. В этом положении контакта (точка Х) сопротивление ячейки Rя определяется соотношением