Лекция Кинетическая теория газов и основные газовые законы
Страница 1 из 6
Лекция Кинетическая теория газов и основные газовые законы
В основе кинетической теории газов лежит понятие «идеальный газ». Это упрощенная математическая модель, пользуясь которой можно объяснить такие понятия, как давление газа, взаимодиффузия, эффузия и т. д.
Понятие идеальный газ предполагает:
-пренебрежимо малый объём частиц,
-хаотическое беспрерывное движение частиц,
-отсутствие взаимодействия между частицами,
-идеально упругие столкновения, не ведущие к потере кинетической энергии.
Согласно теории средняя кинетическая энергия частиц в газообразном состоянии пропорциональна температуре по абсолютной шкале Кельвина.
Основными параметрами, описывающими состояние газа являются объём (V), температура (Т) и давление (Р), связанные между собой эмпирическими зависимостями - газовыми законами.
Закон Бойля - Мариотта: при Т = соnst давление данной массы газа обратно пропорционально его объёму:
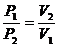 или РV = const (1.1)
или РV = const (1.1)
Закон Гей-Люссака: при р = const объём газа прямо пропорционален абсолютной температуре:
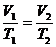 или V/T= const (1.2)
или V/T= const (1.2)
Закон (гипотеза Авогадро): В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Следствие: Одинаковое число молекул разных газов при одинаковых условиях занимает одинаковый объем.
При решении конкретных физико – химических задач приходится сопоставлять результаты экспериментов, приводя их к единому «химическому масштабу». Таким масштабом являются «нормальные условия», которым отвечает температура, равная 0оС (273,15 К) и давление, равное 1 атмосфере (1,01325·105 Па или 760 мл рт. ст.). В таких условиях 1 моль идеального газа (6,02 1023 молекул) занимает объем 22,4 л (22,4 10-3 м3)
Объём газа, его давление и абсолютная температура связаны между собой уравнением, объединяющим законы Бойля - Мариотта и Гей-Люссака:
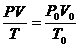 (1.3)
(1.3)
Где Р0, V0 и Т0- параметры газа при Нормальных условиях:
Привести объём газа к нормальным условиям – это значит пересчитать его объём при заданных условиях на объём при нормальных условиях:
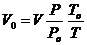 (1.4)
(1.4)
Произведение постоянных величин P0V0/T0 обозначается буквой R. Это универсальная газовая постоянная. В системе СИ она имеет размерность:
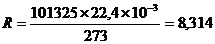 Дж/моль К или 8,314 103 Дж/кмоль К
Дж/моль К или 8,314 103 Дж/кмоль К
Если давление газа измерено в атмосферах, а объем в литрах, то численное значение R = 0,082 л атм/моль К.
При измерении объема в мл, а давления в миллиметрах ртутного столба значение универсальной газовой постоянной R = 62 360 мл мм рт. ст./моль К
Таким образом, для 1 кмоль газа pV=RT,
Для n кмоль газа:
pV= nRT (1.5)
Это выражение известно как Уравнение Менделеева - КлаЙПерона или уравнение состояния идеального газа.
Для реальных газов Ван-дер-Ваальс ввел в уравнение (1.5) поправки, учитывающие взаимное притяжение молекул (а) и собственный объём (в):
Для n молей газа: 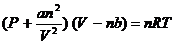 (1.6)
(1.6)
Константы 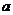 И
И 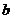 Для различных газов даны в приложении 1.
Для различных газов даны в приложении 1.
Контрольные вопросы.
1. Сформулируйте основные допущения кинетической теории газов.
2. Каким образом кинетическая теория объясняет:
а) взаимодействия газов;
Б) давление, создаваемое газом;
В) сжимаемость газов;
Г) равнозначность давления по всем направлениям;