Методические рекомендации к проведению лабораторно-практических занятий по коллоидной химии на тему: Гидрозоли. Получение, устойчивость, коагуляция, Электрокинетические явления в коллоидных системах.
Страница 4 из 8
Определить знаки заряда частиц, полученных в опытах №№ 1 –3.
Опыт 5. Наблюдение светорассеяния.
Золь налить в кюветку с плоскопараллельными стенками. Пропустить через него световой луч от проекционного фонаря. Наблюдать сбоку светорассеяние ( конус Тиндаля).
Параллельно тот же опыт поставить с водой. Отметить разницу в светорассеянии.
Опыт 6. Очистка золей диализом.
В коллоидный мешочек налить горячий золь Fe(OH)3 (Опыт 2). Подвесить мешочек на стеклянной палочке и погрузить в стакан с горячей дистиллированной водой. Через 10 – 15 минут определить присутствие ионов Cl и отсутствие окрашивания в воде, омывающей мешочек. Прошли ли мицеллы через мембрану?
1.4.2. Определение порога коагуляции золя гидроксида железа (+3).
Цель работы: 1. Определить порог коагуляции золя Fe(OH)3 при действии
KCl, K2SO4 , K3[Fe(CN)6].
2. Рассчитать отношение порогов коагуляции.
3. Проверить правило Шульце – Гарди.
Ход работы: Использовать золь Fe(OH)3 , приготовленный в работе 1 (Опыт2).
Приготовить водные растворы:
KCl – 2 М
K2SO4 – 0,05 М
K3[Fe(CN)6] – 0,005 М
Отбирают в три колбы для титрования по 5 мл. охлажденного золя. Из бюретки медленно, по каплям, хорошо перемешивая, добавляют 0,005 М раствор гексацианоферрата (+3) калия до помутнения золя. Повторяют операцию с раствором K2SO4 и KCl
Для расчета берут среднее значение по результатам 3 – х титрований.
Порог коагуляции рассчитывают по формуле:
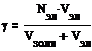 где:
где:
G - пороговое значение концентрации электролита; моль/л.
Vзоля – объём взятого золя, мл.
Vэл – объём электролита добавленный, до помутнения золя, мл.
Nэл – нормальность электролита, моль/л.
Составляют пороговые значения для трёх электролитов: gCl : gSO4 : g[Fe(CN)6] и сравнивают результаты с правилом Шульце – Гарди.
1.4.3. Изучение явления защиты золя.
Цель работы: Определить защитное действие желатина на золь Fe(OH)3
Ход работы: В работе используется золь Fe(OH)3, приготовленный в работе 1 (опыт 2).
Приготовить водные растворы: (NH4)2SO4 – 0,02 М желатина – 0,5%.
1. Оттитровать 10 мл. золя Fe(OH)3 0,02 М раствором (NH4)2SO4 до помутнения раствора.
2. К новой порции 10 мл. золя Fe(OH)3 добавить 1 мл. 0,5% раствора желатина, пороговое количество раствора (NH4)2SO4. Отметить наступила ли коагуляция?
3. К третьей порции 10 мл. золя Fe(OH)3,защищённого 1 мл. раствора желатина, добавить сухой порошок (NH4)2SO4 на кончике шпателя, нарушающий устойчивость раствора желатина.
Описать явление.
Объясните почему белые хлопья желатина, выпавшие вначале, постепенно окрашиваются в белый цвет?
2. Электрокинетические явления.
2.1. Теоретические основы.
Электрокинетические явления открыты профессором московского университета Ф. Ф.Рейссом в 1808г. И дополнены исследованиями Квинке (18 г) и Дорна (18 г).
Причиной всех электрокинетических явлений является наличие двойного электрического слоя на границе раздела фаз. Заряд на коллоидных частицах обусловлен избирательной адсорбцией одного из ионов электролита, находящегося в дисперсной фазе. Согласно правилу Пескова – Фаянса адсорбируются ионы, входящие в состав ядра мицеллы. Они называются Потенциалопределяющими. Так как в целом коллоидная система электронейтральна, в среде, окружающей ядро мицеллы, должны находится ионы противоположного знака. Так образуется двойной ионный слой, (рис. 2.1) состоящий из двух частей: адсорбционной и диффузной.
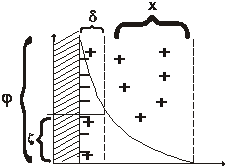
Рис 2.1. Схема строения двойного электрического слоя.
Адсорбционный слой противоионов находится на расстоянии молекулярного радиуса от заряженной поверхности. Ионы этого слоя прочно удерживаются поверхностью ядра. Толщина слоя d постоянна и не зависит от концентрации электролита и температуры. Остальные противоионы образуют диффузную часть толщины х, зависящей от концентрации электролита в дисперсионной среде. При увеличении концентрации электролита диффузионный слой сжимается, так, что остаётся только адсорбционный слой – (Рис. 2.2.).