МЕТОДИЧЕСКИЕ УКАЗАНИЯ по выполнению лабораторно-практических занятий по дисциплине «Физическая и коллоидная химия» «Гетерогенные равновесия. Фазовые диаграммы температура кипения - состав для двухкомпонентных систем»
Страница 6 из 9
Для отработки техники измерения в работе используются жидкие органические вещества с известным значением показателя преломления (Приложение. Таблица 5.9)
Лабораторная работа №2. Определение состава бинарной смеси методом рефрактометрии. Построение калибровочной кривой показатель преломления – состав смеси
Оборудование и реактивы: Рефрактометр, сухие колбы (50мл), мерные пипетки (5, 10 мл), оплавленная стеклянная палочка, бумажные салфетки (вата), этанол, пропанол, бутанол, ацетон, бензол, толуол (возможен другой набор реактивов).
На диаграммах равновесия «жидкость – пар» состав смеси, как правило, выражается в молярных долях (процентах). В то же время для приготовления смесей берут определенные объемы жидких компонентов (состав смеси выражается в этом случае объемными долями или процентами). Для перевода объемных процентов в молярные необходимо найти число молей каждого компонента ni = vi/Vi, где vi – объем компонента в растворе, а Vi = Mi/ρi – молярный объем этого компонента в чистом виде (М – молярная масса, г/моль, ρ – плотность, г/мл). Для бинарной смеси молярную долю компонента в растворе находят по уравнению:
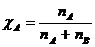 (3.1)
(3.1)
Ход работы:
1. Приготовить растворы из заданных преподавателем органических веществ, содержащие 20, 40, 60 и 80 объемных процентов компонента А.
2. Произвести пересчет объемных процентов компонентов в смеси на молярные, пользуясь справочными данными плотностей веществ для расчета молярного объема (Приложение. Таблица 5.9).
3. Измерить показатели преломления чистых веществ и приготовленных смесей. Смеси оставить для последующих опытов.
4. На миллиметровой бумаге построить калибровочный график в координатах показатель преломления – состав смеси в молярных процентах.
5. Определить состав контрольной смеси с помощью полученной калибровочной кривой.
6. Вычислить величину относительной погрешности измерения.
Лабораторная работа №3. Построение диаграммы температура кипения - состав
Оборудование и реактивы: Прибор для определения температур кипения, сухие бюксы с притертыми крышками для отбора дистиллята, рефрактометр, растворы, калибровочный график (лабораторная работа №2).
Ход работы:
1. Собрать прибор для определения температуры кипения, состоящий из сосуда для кипячения (колба Вюрца) (1), термометра (2), холодильника (3) и водяной или песочной бани (4) (рис. 3.1).
2. Укрепить сосуд для кипячения при помощи лапки на штативе, налить в него смесь известного состава. Во избежание перегрева жидкости в сосуд поместить стеклянные капилляры. В горлышко сосуда вставить пробку с термометром так, чтобы шарик термометра был погружен в жидкость. В холодильник пропустить воду. Медленно нагреть смесь до тех пор, пока температура кипящей жидкости перестанет заметно изменяться.
3. Снять показания термометра. Из нижнего шарика холодильника отобрать пробу конденсата с помощью пипетки, поместить пробу в сухой бюкс, охладить до комнатной температуры и измерить показатель преломления. (Внимание! Температуры кипения смеси до и после отбора пробы не должны отличаться более чем на один градус.)
4. Прекратить нагрев. Охладить сосуд. Вылить из него смесь в емкость для сбора органических жидкостей.
5. Повторить операции 2 – 4 для смесей другого состава.
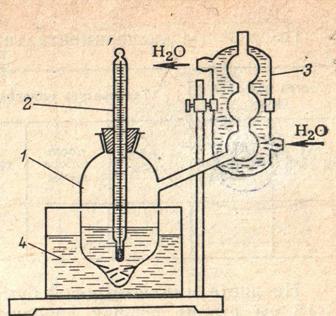
Рис. 3.1. Прибор для определения температуры кипения жидкой смеси.
Обработка результатов эксперимента:
1. Занести полученные экспериментальные данные в таблицу.
2. На листе миллиметровой бумаги построить диаграммы температура кипения – состав жидкой смеси и температура кипения – состав пара.
3. Проанализировать полученную диаграмму, пользуясь правилом фаз Гиббса.
Таблица 3.2. Сводная таблица экспериментальных данных
|
Состав исходной смеси, молярные %, Х(A)
|
Температура кипения, оС
|
Показатель преломления, n20D
|
Состав пара, молярные %,Y(А)
|
|
До отбора пробы
|
После отбора пробы
|
Средняя
|
Исходной смеси
|
Сконден-сированного пара
|
|
|
|
|
|
|
|
4. Обучающие задания
4.1. Гомогенные двухкомпонентные системы, образованные неограниченно взаимно растворимыми жидкостями
Названные физико-химические системы можно отнести к группе идеальных растворов. В соответствии с Законом Рауля В идеальных растворах наблюдается линейная зависимость парциального давления насыщенных паров от молярной доли каждой жидкости в смеси:
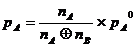 Или
Или 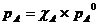 , (1)
, (1)
Где 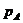 - парциальное давление,
- парциальное давление,  - молярная доля жидкости А в смеси,
- молярная доля жидкости А в смеси,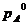 - равновесное давление пара над чистым растворителем.
- равновесное давление пара над чистым растворителем.