МЕТОДИЧЕСКИЕ УКАЗАНИЯ по выполнению лабораторно-практических занятий по дисциплине «Физическая и коллоидная химия» «Гетерогенные равновесия. Фазовые диаграммы температура кипения - состав для двухкомпонентных систем»
Страница 3 из 9
/ Напомним: 
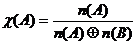 ,
, 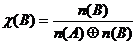 /
/
Часто на практике необходимо изучить изменение какого-либо свойства в зависимости от состава системы т. е. получить диаграммы Состав – свойство.
Чтобы построить диаграммы состав – свойство, по вертикали от оси состава откладывают измеряемый параметр (температуру, давление, вязкость, плотность, поверхностное натяжение, электропроводность и т. д.).
* Если диаграмма состав – свойство связывает состав с температурой или давлением, то такая диаграмма называется Диаграммой состояния.
* Если на диаграмме состояния изображены разные фазы (твердая, жидкая, газообразная, аллотропные модификации и пр.) системы, то такая диаграмма называется фазовой диаграммой.
При трех переменных (состав, Т, Р) фазовая диаграмма должна изображаться в трехмерном пространстве. Чтобы перейти к плоскому изображению, необходимо один из параметров зафиксировать, то есть сохранять постоянным, и работать в изобарных или изотермических условиях.
В зависимости от природы веществ А и В на практике может наблюдаться ряд типов кривых состав-свойство (Рис.2.2.).
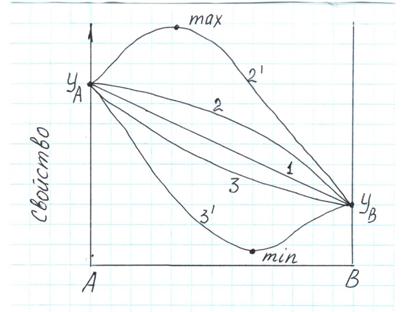
Рис. 2.2. Типы кривых состав-свойство двойных систем.
1. Кривая свойства – прямая линия, то есть изучаемое свойство линейно зависит от концентрации компонентов. В этом случае свойство является аддитивным и может быть вычислено по правилу смешения: Y = YA χA + YB (1 – χA)
2. Кривая с положительным отклонением, иногда с максимумом (21). В этом случае величина изучаемого свойства, вычисленная по правилу смешения, меньше полученной опытным путем.
3. Кривая с отрицательным отклонением, иногда с минимумом (31). В смешения, больше величины, полученной экспериментально.
Причины положительного или отрицательного отклонения могут иметь различную природу. В качестве примера рассмотрим Однофазную двойную жидкую систему, образованную из взаимно растворимых жидкостей. В ней могут протекать следующие процессы:
1). Ассоциация и диссоциация. Если молекула растворенного вещества ассоциирована АХ (электростатическое или диполь-дипольное взаимодействие между молекулами), в растворителе может произойти молекулярная диссоциация: АХ ↔ хА. При этом энергия, необходимая для разрыва ассоциата черпается из химического взаимодействия между ассоциатом и растворителем.
2).Химическое взаимодействие между компонентами системы.
А) Взаимодействие без глубокой перестройки, ассоциация: mA + nB ↔AmBn
(CH3CO)2O + H2O ↔ 2CH3COOH
B) Глубокая перестройка, необратимая химическая реакция: mA + nB ↔ pC
C3H5NCS + C2H5NH2 = C2H5NHCSNHC3H5
C) Обменное взаимодействие: mA + nB ↔ pC + qD, например, реакция этерификации: RCOOH + R1OH ↔ R – COOR1 + H2O
3). Ионизация продуктов присоединения – Это процесс, который может рассматриваться как этап, предшествующий электролитической диссоциации. Так, в растворах с недостаточной диэлектрической проницаемостью дальнейшая электролитическая диссоциация не произойдет.
AmBn ↔[ pKq+] [ qLp-]
4). Электролитическая диссоциация характерна для систем с высокой диэлектрической проницаемостью, например: вода – минеральная кислота в области малых концентраций, когда степень диссоциации близка к 100%