МЕТОДИЧЕСКИЕ УКАЗАНИЯ по выполнению лабораторно-практических занятий по дисциплине «Физическая и коллоидная химия» «Гетерогенные равновесия. Фазовые диаграммы температура кипения - состав для двухкомпонентных систем»
Страница 7 из 9
Общее давление над раствором слагается из парциальных давлений:
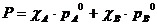 (2)
(2)
По следствию из Закона Дальтона парциальные давления веществ А и В в парах пропорциональны их молярным долям в паровой фазе:
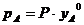 , (3)
, (3)
Где 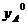 - молярная доля паров вещества А в газовой (паровой) фазе.
- молярная доля паров вещества А в газовой (паровой) фазе.
Объединяя уравнения 1,2 и 3, получим:
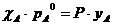 или
или 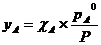 (4).
(4).
Решив уравнение 4 относительно общего давления Р, выраженного через вещества А и В, и приравняв их, получим:
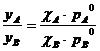 (5).
(5).
Уравнение приводит к интересному выводу: Состав жидкой фазы отличается от состава равновесной ей паровой фазы!
Пример 1. Рассчитать при 30оС общее давление и состав пара над смесью, состоящей из 117,2 г бензола и 884,5 г толуола. Давление паров над чистыми веществами составляет: р0(С6Н6) = 15 756 Па, р0(С6Н5СН3) = 4 892 Па.
Решение:
1) Найдем количества вещества бензола и толуола:
n(С6Н6) = 117,2/78,11 = 1,5моль, n (С6Н5СН3) = 884,2/92,14 = 9,6 моль
2) Рассчитаем молярные доли бензола и толуола:
χ(С6Н6) = 1,5/(1,5 + 9,6) = 0,1352, χ (С6Н5СН3) = 9,6/(1,5 + 9,6) = 0,8648
3) Найдем парциальные давления бензола и толуола:
Р(С6Н6) = 15 756×0,1352 = 2 130 Па, р(С6Н5СН3) = 4 892×0,8648 = 4 232 Па
4) Общее давление паров составит: Р = 2 130 +4 232 =6 362 Па
5) Молярные доли паров бензола и толуола над смесью:
y(С6Н6) = 15 756×0,1352/6 362 = 0,3351
y(С6Н5СН3) = 4 892×0,8648/6 362 = 0,6649
Таким образом, По сравнению с жидкой фазой, пар богаче более летучим компонентом – бензолом. Это вполне согласуется с первым законом Коновалова.
Эту же задачу проще и рациональнее решить табличным способом:
|
Вещество
|
Масса,
M, г
|
Давление паров над веществом, р0, Па
|
Молярная масса, М, г/моль
|
Количество вещества
n= m/М
|
Молярная доля вещества в растворе, χ
|
Парциальное давление, р=р0 χ
|
Молярная доля вещества в паровой фазе, y=р/Р
|
|
Бензол
|
117,2
|
15756
|
78,11
|
1,5
|
0,1352
|
2130
|
0,3351
|
|
Толуол
|
884,5
|
4892
|
92,14
|
9,6
|
0,8648
|
4232
|
0,6649
|
|
Смесь
|
|
|
|
11,1
|
1,0000
|
6362
|
1,0000
|
Задачи для самостоятельного решения
1. Определите общее давление и состав пара в молярных долях над смесью, состоящей из 125 г бензола и 98 г пара-ксилола (С6Н4(СН3)2), при 50оС. Давление паров бензола 35863 Па, а пара-ксилола 6561 Па.
2. Вычислите общее давление и определить состав пара в молярных долях над смесью, состоящей из 200 г бензола и 300 г этилбензола при 60оС. Давление паров бензола 51809 Па, этилбензола – 10484 Па.
3. При 25оС давление пара хлороформа 199,1 Па, а четыреххлористого углерода 114, мм рт. ст. Полагая, что жидкости образуют идеальный раствор, определите: а) состав пара, находящегося в равновесии с раствором, содержащим по 1 моль каждого вещества; б) общее давление паров над раствором.
4. Этанол и метанол образуют почти идеальные растворы. При 20оС давление паров этанола 44,5 , метанола 88,7 мм рт. ст. Рассчитайте: а) молярные доли спиртов в растворе, полученном при смешивании по 100 г каждого спирта; б) парциальные давления и общее давление пара раствора; в) молярную долю метанола в паре.
5. При 100оС бензол имеет давление паров 1357, а толуол 556 мм рт. ст. Предполагая, что эти соединения образуют идеальные растворы, рассчитайте состав раствора, который будет кипеть при 100 оС и 1 атм., а также состав пара, равновесного с этим раствором.
6. При 30 оС давление паров бензола 15756, а толуола 4892 Па. Рассчитайте: а) молярные доли компонентов в растворе, полученном при смешивании по 1оо г каждого вещества; б) общее давление и состав пара в молярных и массовых долях; в) отношение числа молей бензола и толуола над жидкостью, содержащей 82 молярных процента бензола и 18 молярных процентов толуола.
7. Общее давление пара над смесью бензола и толуола 8691,2 Па при 300С. Найдите молярные доли бензола и толуола в жидкой смеси и в парах при указанной температуре. Давление паров бензола при температуре опыта 15758,6 Па, а толуола 4892,92 Па.