МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 3 из 16
Подвижность иона – произведение его абсолютной скорости на число Фарадея: λ = F(UK+ + UA-)
В растворах слабых электролитов межионные взаимодействия слабы и ионы движутся независимо друг от друга при любой концентрации. Сопоставляя эквивалентную электрическую проводимость при заданной концентрации слабого электролита с предельным значением, можно вычислить степень диссоциации:
α = λС/ λ∞ (1.2.3)
В растворах сильных электролитов при явлении электропроводности необходимо учитывать специфичность взаимодействия движущихся ионов. Для этого вводится Коэффициент электропроводности Fλ (Бьеррум). Коэффициент электропроводности отличается от коэффициента активности γ, который относится к растворам в равновесном состоянии (!). Значение fλ легко найти из соотношения, аналогичного уравнению 1.2.3:
Fλ = λС/ λ∞ (1.2.4)
Величина fλ зависит от концентрации электролита и его валентного типа. В 0,1Н растворе электролита 1-1 (КА) fλ=0,8; 1-2 или 2-1 (К2А или КА2) fλ =0,7; 1-3 или 3-1 (К3А или КА3) fλ = 0,4.
Для сильных электролитов зависимость эквивалентной электропроводности от концентрации выражается по-разному. В области малых концентраций, когда С < 0,01 моль/л, концентрационная зависимость описывается уравнением Кольрауша – Онзагера, называемым законом квадратного корня:
λС = λ∞ - А√С (1.2.5)
Для более высоких концентраций – законом кубического корня:
λС = λ∞ - А1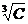 (1.2.6)
(1.2.6)
Для слабых электролитов концентрационная зависимость имеет вид:
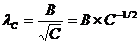 (1.2.7),
(1.2.7),
или в логарифмической форме:
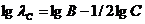 (1.2.8).
(1.2.8).
Величины А, А1, В зависят от температуры, вязкости, диэлектрической проницаемости среды, природы и типа электролита.
1.3. Практическое применение электропроводности водных растворов электролитов
1.3.1. Ионные равновесия. Определение степени и константы диссоциации слабых электролитов, коэффициента электропроводности (кажущейся степени диссоциации) сильных электролитов
Для количественного описания процесса диссоциации растворенных веществ на ионы можно использовать законы химического равновесия, применяемые к химическим реакциям при постоянных температуре и давлении или температуре и объеме. В растворах слабых электролитов ионное равновесие устанавливается между недиссоциированными молекулами и ионами при любой концентрации и подчиняется закону действия масс. Рассмотрим диссоциацию молекул слабого электролита на два однозарядных иона:
КА + Н2О ↔ К+ + А-
Согласно закону действия масс имеем:
К = 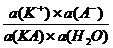 (1.3.1)
(1.3.1)
Активность воды в разбавленных растворах практически постоянна, поэтому произведение 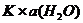 =const обозначают КД и называют Термодинамической константой диссоциации:
=const обозначают КД и называют Термодинамической константой диссоциации:
КД, а =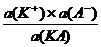 (1.3.2)
(1.3.2)
Если концентрация слабого электролита мала, вместо активностей можно брать значения молярной концентрации и уравнение (3.2) примет вид:
КД, с = 
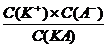 (1.3.3)
(1.3.3)
Пусть степень диссоциации электролита при заданной молярной концентрации С равна αС. В состоянии равновесия С(К+) = С(А-) = αС С;
С(КА) = (1 - αС) С, тогда
КД, с = 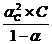 (1.3.4)
(1.3.4)
Полученное выражение является математическим описанием Закона разведения Оствальда. Так как αС =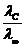 , то
, то
КД, с = 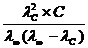 (1.3.5)
(1.3.5)
Величину КД, с называют классической константой диссоциации, условной константой диссоциации и т. п. Она имеет постоянное значение только для очень разбавленных растворов, когда средний ионный коэффициент активности γ±→1. Для растворов электролитов типа КА с малой ионной силой
КД, а = КД, с γ±2 (1.3.6)