Методические рекомендации к проведению лабораторно-практических занятий по коллоидной химии на тему: Гидрозоли. Получение, устойчивость, коагуляция, Электрокинетические явления в коллоидных системах.
Страница 2 из 8
( Установлено Гарди в 1900г.)
Это связано со сжатием диффузного слоя до Z=0 ( изоэлектрическое состояние ).
Начало коагуляции золя определяется по его помутнению, выпадению осадка, изменению окраски. Коагуляция начинается при достижении некоторого достаточно малого значения
Z - Потенциала, называемого критическим (ZКрит).
Для многих золей Z» 30 – 50 мВ.
Наименьшее количество электролита, вызывающего начало коагуляции, называется Порогом коагуляции (G):
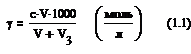
Где: с – концентрация электролита, моль/л;
V3 – объём золя, мл;
V – объём раствора электролита, достаточный для начала коагуляции, мл.
Величина, обратная порогу коагуляции, называется коагулирующей способностью иона:
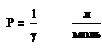
Согласно эмпирическому правилу Шульце – Гарди, коагулирующее действие иона тем больше, чем выше его валентность. Коагулирующие способности одно, двух и трехзарядных ионов находятся в соотношении:
Р1 : Р2 : Р3 = 1 : 50 : 1000
G1 : g2 : g3 =1 : 0,02 : 0,001
Современная теория устойчивости и коагуляции коллоидных систем, созданная Дерягиным, Ландау, Фервеем, Овербеком (теория ДЛФО) предполагает, что порог коагуляции связан с зарядом коагулирующего иона соотношением
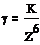 где К – коэффициент, характеризующий дисперсную фазу, среду и структуру двойного электролитического слоя.
где К – коэффициент, характеризующий дисперсную фазу, среду и структуру двойного электролитического слоя.
Теория обосновывает и подтверждает эмпирически полученное правило Шульце – Гарди


1.2 Задачи для самостоятельного решения.
1.2.1. Для некоторого золя пороги коагуляции оказались равными (моль/л)
СKNO3 = 50,0; CMgCl2 = 0.717; CAlCl3 = 0.093;
CNaCl = 51.0; CMgSO4 = 0.810; C Al(NO3) = 0.095
Определить знак заряда золя
1.2.2. Для золя AgI определены пороги коагуляции (моль/л)
СKCl = 256.0; CBa(NO3)2 = 6.0; C Al(NO3)3 = 0.067;
CKNO3 = 260.0; C Sr(NO3)2 = 7.0;
Определить знак гранулы золя и написать формулу мицелы.
1.2.3. В три колбы налито по 100 см. куб. золя Fe(OH)3. Для явной коагуляции золя потребовалось добавить в первую - 10,5 мл. 1 н. KCl; во вторую 62,5 мл. 0,01 н. Na2SO4; в третью – 37,0 мл 0,001 н. Na3PO4. Вычислить пороги коагуляции и определить знак частиц золя.
1.2.4. Золь AgCl получен смешиванием равных объёмов 0,0095 М KCl и 0,012 н. AgNO3 какой из электролитов: K3[Fe(CN)6], K4[Fe(CN)6], или MgSO4 будет обладать наименьшей коагулирующей способностью?