МЕТОДИЧЕСКИЕ УКАЗАНИЯ По выполнению лабораторно-практических занятий и заданий для самостоятельных работ по дисциплине «Физическая и коллоидная химия»
Страница 5 из 11
2. Лабораторная работа №2
Изучение процесса адсорбции ПАВ из водных растворов на поверхности раздела жидкость – воздух
2.1. Цель и задачи работы
Ознакомиться с процессом адсорбции ПАВ из водных растворов на поверхности раздела жидкость – воздух.
Освоить графические приемы обработки результатов эксперимента.
Исследовать влияние растворения различных веществ в воде на величину поверхностного натяжения; установить характер адсорбции (положительная или отрицательная).
Проследить зависимость поверхностного натяжения водных растворов карбоновых кислот и спиртов (ПАВ) от концентрации. На основе экспериментальных данных построить изотерму адсорбции, вычислить величину максимальной адсорбции, толщину адсорбционного слоя, площадь, занимаемую в поверхностном слое одной молекулой.
Проверить, соответствуют ли полученные результаты правилу Траубе – Дюкло?
2.2. Основные сведения об адсорбции ПАВ из водных растворов на поверхности раздела жидкость – воздух
Адсорбцией называется самопроизвольный процесс концентрирования вещества у поверхности раздела фаз.
Любая жидкость обладает свободной поверхностной энергией, мерой которой является величина поверхностного натяжения. Свободная поверхностная энергия стремится принять минимальное значение. Это может осуществляться двумя путями: 1) уменьшением поверхности раздела фаз, 2) понижением удельной свободной поверхностной энергии. Второй путь связан с использованием веществ, способных понижать поверхностное натяжение, поверхностно - актиных веществ или ПАВ. Для границы раздела вода – воздух в качестве ПАВ часто выступают органические соединения дифильной природы, то есть содержащие полярные группы (гидроксильную, карбоксильную, аминогруппу и пр.) и неполярный алкильный углеводородный радикал. На границе раздела фаз полярные группы, обладающие большим сродством к воде, остаются в воде, а неполярные выталкиваются в малополярную среду – воздух (рис. 2.1).
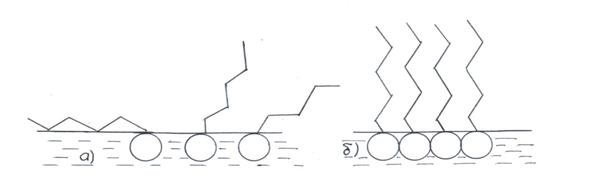
Рис. 2.1 Ориентация дифильных молекул на границе раздела вода – воздух.
Вследствие того, что молекулы ПАВ имеют достаточно большие, но слабо взаимодействующие между собой неполярные части, межмолекулярное взаимодействие ПАВ меньше, чем у молекул воды. Из этого следует, что при концентрировании молекул ПАВ у поверхности раздела вода – воздух поверхностное натяжение растворов будет всегда меньше, чем у чистой воды.
Величина адсорбции определяется разностью концентраций адсорбата (молекул ПАВ) в поверхностном слое и в объеме жидкой фазы в состоянии равновесия. Связь между величиной адсорбции (Г, кмоль/м2), поверхностным натяжением (σ, Н/м) и концентрацией растворенного адсорбирующего вещества (с, кмоль/м3 или моль/л) Для разбавленных растворов установлена в 1876 г. Гиббсом:
Г = 
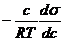 (2.1),
(2.1),
Где с – равновесная концентрация растворенного вещества в объеме раствора. Величина - 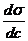 при с→0 (введение первых порций ПАВ) служит относительной характеристикой адсорбционной способности ПАВ Она называется Поверхностной активностью и обозначается символом G (в честь Гиббса). Из уравнения Гиббса следует, что при
при с→0 (введение первых порций ПАВ) служит относительной характеристикой адсорбционной способности ПАВ Она называется Поверхностной активностью и обозначается символом G (в честь Гиббса). Из уравнения Гиббса следует, что при 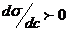 Г < 0; концентрация растворенного вещества в поверхностном слое меньше, чем во всем объеме раствора – это отрицательная адсорбция. Ею обладает большинство растворов электролитов, диссоциирующие в водном растворе на ионы, которые более полярны, чем вода. При
Г < 0; концентрация растворенного вещества в поверхностном слое меньше, чем во всем объеме раствора – это отрицательная адсорбция. Ею обладает большинство растворов электролитов, диссоциирующие в водном растворе на ионы, которые более полярны, чем вода. При 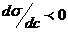 Г > 0; растворенное вещество самопроизвольно концентрируется у поверхности раздела фаз – это положительная адсорбция.
Г > 0; растворенное вещество самопроизвольно концентрируется у поверхности раздела фаз – это положительная адсорбция.
Между поверхностной активностью и химическим строением молекул ПАВ существует определенная связь. Чем меньше полярность веществ, тем больше поверхностная активность их водных растворов. С увеличением длины углеводородного радикала растворимость дифильных молекул в воде уменьшается, поэтому возрастает энергетический выигрыш при переходе их на поверхность раздела фаз. При исследовании гомологических рядов были обнаружены четкие изменения поверхностной активности, которые позволили в конце 1Х ст. Дюкло и Траубе сформулировать правило:
Поверхностная активность увеличивается в 3 – 3,5 раза при удлинении углеводородной цепи на одно звено ( - СН2-).
Ленгмюр установил, что это правило справедливо только при свободном расположении адсорбированных молекул в поверхностном слое параллельно поверхности. При этом возникает двухмерный адсорбционный слой, подобный газовому состоянию. Фактически же это работа, которую необходимо совершить для раздвижения диполей воды на величину объема - СН2- группы. Вытеснение этой группы диполями воды приводит к уменьшению растворимости с ростом длины цепи. В предельном случае молекулы дифильных ПАВ образуют на поверхности воды насыщенный слой или мономолекулярную пленку (рис. 2.1. б). Молекулы ПАВ с несколькими симметрично расположенными полярными группами (дикарбоновые кислоты и их эфиры) сохраняют горизонтальную ориентацию в адсорбционном слое вплоть до насыщения (Таубман). При этом коэффициент формулы Траубе – Дюкло уменьшается до значения 2,6. Площадь же, занимаемая молекулой в поверхностном слое растет с увеличением длины цепи. Кроме этого необходимо учитывать гидратацию полярных групп в адсорбционном слое. В табл.4.3 приложения даны площади, приходящиеся на одну молекулу, вернее площади, занимаемые полярной группой веществ некоторых гомологических рядов, полученные экспериментально.