МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 4 из 16
Зная константу диссоциации, можно рассчитать изменение стандартных значений термодинамических функций при электролитической диссоциации. Стандартное изменение изобарно-изотермического потенциала (энергии Гиббса) ΔGД0 вычисляют для стандартных условий, когда  , по уравнению:
, по уравнению:
ΔGД0 = - RT lg КД, а = -19,148 T lg КД, а, Дж/моль (1.3.7)
Стандартное изменение энтальпии ΔНД0 определяют по значениям двух констант диссоциации, полученных для температур Т1 и Т2.
ΔНД0 = 2,303 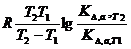 , Дж/моль (1.3.8)
, Дж/моль (1.3.8)
Стандартное изменение энтропии ΔSД0 вычисляют по полученным значениям энергии Гиббса и энтальпии:
ΔSД0 = (ΔНД0 - ΔGД0) / Т (1.3.9)
Пример 1. Сопротивление 0,05Н раствора нитрата серебра при 18оС, измеренное в сосуде с электродами, емкость сопротивления которых 0,5 см-1 равно 100 Ом. Найдите удельную электропроводность и коэффициент электропроводности fλ электролита. (Подвижности ионов даны в приложении, табл.1).
Решение: Емкость сопротивления электродов в электролитической ячейке представляет собой не что иное, как константу сосуда l/s =0,5 см-1.
Удельная электропроводность связана с константой сосуда K и сопротивлением R соотношением: κ = К/R, следовательно, κ = 0,5/100 = 5 10-3 См/см.
Коэффициент электропроводности или кажущаяся степень диссоциации электролита может быть рассчитана по формуле: fλ = λС/λ∞. При этом предельное значение эквивалентной электропроводности λ∞ = λ(Ag+) + λ(NO3-). Воспользовавшись справочными данными, получим:
λ∞ = 54 + 61,6 = 115,6 См см2/моль
Эквивалентная электропроводность при заданной концентрации электролита λС = 1000 κ/СЭ, λС = 103×5×10-3/0,05 = 100 См см2/моль.
Величина коэффициента электропроводности: fλ=100/115,6 =0,865 или 86,5%
Пример 2. Удельная электропроводность водного раствора уксусной кислоты с концентрацией 0,1 моль/л имеет величину 0,000471 См/см. Эквивалентная электропроводность уксусной кислоты при бесконечном разведении 389 См см2/моль. Определите степень и константу диссоциации кислоты.
Решение: α = λС/λ∞. При этом λС = 1000 κ/СЭ,
λС = 103×4,71×10-4/10-1=4,71 См см2/моль и α = 4,71/389 =0,012 или 1,2%. Константа диссоциации
КД, с = 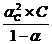 , КД, с=(0,012)2 ×0,1/(1- 0,012) = 1,45 10-5
, КД, с=(0,012)2 ×0,1/(1- 0,012) = 1,45 10-5
Задачи для самоподготовки
1.3.1. При 18оС удельная электропроводность раствора муравьиной кислоты составила 5,5×10-3 См/см. Массовая доля кислоты 0,0494, плотность раствора 1,012г/см3. Найдите степень и константу диссоциации кислоты.
1.3.2 Уксусная кислота, массовая доля которой в водном растворе 4,33%, а плотность раствора 1,005 г/см3 , имеет величину удельной электропроводности 1,2×10-3 См/см. Найдите степень и константу диссоциации кислоты.
1.3.3. При 18оС удельная электропроводность 5%-ного раствора нитрата магния составляет 4,38×10-2 См/см. Вычислите коэффициент электропроводности соли в растворе. Плотность раствора принять равной плотности воды.
1.3.4. Чему равна кажущаяся степень диссоциации хлорида кальция при 18оС, если удельная электропроводность 10%-ного раствора равна 0,114 См/см, а плотность раствора 1,08 г/см3?
1.3.2. Определение предельной эквивалентной электрической проводимости
Предельную эквивалентную электрическую проводимость Сильных электролитов находят посредством экстраполяции опытных данных, представленных на графике 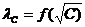 , к С→ 0.
, к С→ 0.
В основе определения предельной эквивалентной электрической проводимости Слабых электролитов лежит закон Кольрауша, позволяющий суммировать эквивалентные электрические проводимости ионов, составляющих электролит, на основе справочных данных (Приложение). Если табличные данные для ионов, составляющих электролит, отсутствуют, можно найти искомое значение  Посредством комбинации
Посредством комбинации  сильных электролитов.
сильных электролитов.
Пример 3. Найденные опытным путем эквивалентные электропроводности KCl, NaCl, KF равны, соответственно, 130,1, 109,0 и 111,25
См см2/моль.
Найдите эквивалентную электрическую проводимость фторида натрия в этих же условиях.
Решение: Согласно закону Кольрауша: (КCl) =
(КCl) =  (K+) +
(K+) +  (Cl-) (1);
(Cl-) (1);  (NaCl) =
(NaCl) =  (Na+) +
(Na+) +  (Cl-) (2);
(Cl-) (2);  (KF) =
(KF) =  (K+) +
(K+) +  (F-) (3).
(F-) (3).
Так как  (NaF) =
(NaF) =  (Na+) + (F-), то эту величину можно найти алгебраическим путем:
(Na+) + (F-), то эту величину можно найти алгебраическим путем:  (NaF) = (2) + (3) – (1) =
(NaF) = (2) + (3) – (1) =  (NaCl) +
(NaCl) +  (KF) -
(KF) -  (KCl).
(KCl).
 (NaF) = 109,0 + 111,2 – 130,1 = 90,1 См см2/моль.
(NaF) = 109,0 + 111,2 – 130,1 = 90,1 См см2/моль.
Задачи для самоподготовки