МЕТОДИЧЕСКИЕ УКАЗАНИЯ По выполнению лабораторно-практических занятий и заданий для самостоятельных работ по дисциплине «Физическая и коллоидная химия»
Страница 9 из 11
Сами константы уравнения находят графически. Для этого уравнение представляют в логарифмическом виде:
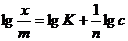 (3.3)
(3.3)
Это уравнение прямой линии в логарифмических координатах (рис. 3.2).
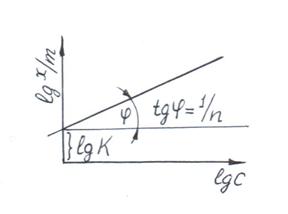
Рис. 3.2. Графическое нахождение констант уравнения Фрейндлиха - Бедекера.
Уравнением Ленгмюра.
Уравнение Ленгмюра хорошо описывает именно начальные участки изотермы (рис. 3.3).
Касательная, проведенная к изотерме адсорбции из начала координат, может служить своеобразной мерой адсорбционной активности вещества. Отрезок В, отсекаемый на линии Г∞ = const равен К = Кадсорбц./Кдесорбц..
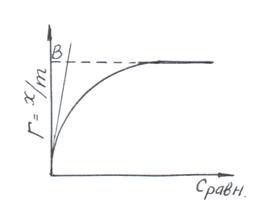
Рис. 3.3. Графическое нахождение константы адсорбционного равновесия по изотерме адсорбции.
До сих пор мы рассматривали только жидкую фазу. Однако в процессе адсорбции большое значение имеет химическая природа и физическое состояние твердой фазы. К типичным адсорбентам предъявляется ряд требований.
Прежде всего – это развитая поверхность, определяющая емкость адсорбента, это высокая селективность по отношению к молекулам ПАВ, это возможность его регенерации с последующим повторным использованием. Кроме того, при использовании процесса в пищевых технологиях немаловажными факторами являются инертность (экологическая чистота) и прочность к истиранию. Наконец, адсорбент должен быть доступен и, по возможности, дешев.
3.3. Экспериментальная часть
Опыт №1. Изучение адсорбции уксусной кислоты на активированном угле.
Оборудование и реактивы: технические весы; набор сит; ступка с пестиком; конические колбы на 250 мл с пробками; бюретка для титрования; пипетки на 5, 10 и 15 мл; сухие колбы для фильтрации и титрования, бумажные фильтры, стеклянные воронки.
Адсорбент - активированный уголь. Водные растворы уксусной кислоты с молярными концентрациями с, моль/л: 0,5; 0,25; 0,1; 0,05; 0,025, водный 0,1 Н раствор гидроксида натрия (фиксанал) для титрования, фенолфталеин.
Ход работы: 1) Подготовить адсорбент. Для этого измельчить в ступке партию адсорбента. С помощью сит отобрать фракцию твердого материала диаметром 1 – 5 мм. Методом квартования взять для проведения опыта 5 навесок адсорбента по 1,5 г каждая, используя технические весы.
Внимание! Для проведения опыта можно использовать таблетки активированного угля, продающегося в аптеке.
2) В 5 конических колб поместить по 1,5 г адсорбента, залить в них по 50 мл исследуемых растворов кислоты с концентрациями с, моль/л: 0,5; 0,25; 0,1; 0,05, 0,025.
3) Встряхивать колбы в течение 30 мин. для установления равновесия сорбция – десорбция.
4) Приготовить 5 сухих колб с воронками, в которые поместить сухие складчатые фильтры. Растворы отфильтровать, отбрасывая первые порции фильтрата (3 – 5 мл).
5) Оттитровать по фенолфталеину исходные и равновесные растворы (по 2 параллельных определения). Для этого из первых двух растворов взять для титрования по 5 мл кислоты, а из последних трех – по 10 мл.
6) Результаты занести в таблицу 3.1.
Таблица 3.1. Результаты титрования кислоты
|
№ оп.
|
До адсорбции
|
После установления равновесия
|
|
Объем кислоты, мл
|
Объем щелочи, мл
|
Концентрация кислоты, моль/л
|
Объем кислоты, мл
|
Объем щелочи, мл
|
Концентрация кислоты, моль/л
|
|
|
|
|
|
|
|
7) Рассчитать величину количества адсорбированного вещества по формуле:
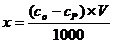
8) Рассчитать величину адсорбции Г = х/m. Результаты опытов занести в таблицу 3.2.
9) Рассчитать величину lg Г и lg c. Результаты занести в таблицу 3.2.
Таблица 3.2. Результаты определения равновесной концентрации кислоты в процессе адсорбции
|
№ пробы
|
1
|
2
|
3
|
4
|
5
|
|
Начальная концентрация кислоты,
Со, моль/л
|
|
|
|
|
|
|
Равновесная концентрация кислоты,
С, моль/л
|
|
|
|
|
|
|
Г, моль/г
|
|
|
|
|
|
|
Lg Г
|
|
|
|
|
|
|
Lg с
|
|
|
|
|
|
10) Построить изотерму адсорбции. Графическим путем найти константу адсорбции.
11) Построить график в логарифмических координатах и найти коэффициенты уравнения Фрейндлиха – Бедекера.
3.4. Контрольные вопросы