МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 7 из 16
Rя = ВХ ×Rr /АХ
Здесь Rr – сопротивление реостата. После того, как найдено сопротивление ячейки, можно вычислить электролитическую проводимость раствора с помощью уравнения
κ = l/S×Rя
Отношение l/S представляет собой постоянную величину, характерную для данной ячейки. Она называется Постоянной ячейки. Ее можно определить, измеряя с помощью данной ячейки сопротивление какого-либо раствора с известной электролитической проводимостью. Наиболее часто для этой цели используется раствор хлорида калия концентрации 0,1 моль/л
Вместо кондуктометрической ячейки для определения электролитической проводимости используются специальные сосуды разной формы. Как правило, они не приспособлены для непосредственного измерения величины удельной электропроводности, потому для каждого сосуда предварительно определяют его постоянную. Она равна отношению расстояния между электродами в сосуде (1) к поперечному сечению столбика (S):
К = l/S
Константа сосуда определяется так же, как и постоянная ячейки.
Пример: Установлено, что раствор хлорида калия концентрации 0,1 моль/л имеет сопротивление 35,2 Ом. Зная, что электролитическая проводимость раствора хлорида калия при температуре опыта равна 1,29×10-2 См/см, вычислить постоянную ячейки.
Решение. Постоянная ячейки определяется соотношением: l/S = Rяκ
К = l/S = (35,2 Ом) (1,29×10-2 См/см) = 45,4×10-2 см-1
!!! Помним, что 1 См = 1 Ом -1
На практике вместо мостика Уитсона используются реохордный мост, подключаемый к высокочастотному источнику переменного тока. Использование источника постоянного тока невозможно из-за того, что это вызовет электролиз раствора.
Ход работы:
1. Сосуд для измерения электролитической проводимости тщательно промывают сначала дистиллированной водой, а затем несколько раз споласкивают 0,1 Н раствором хлорида калия. Заполняют сосуд раствором хлорида калия так, чтобы он полностью покрыл электроды. Подключают контактные провода сосуда к клеммам со значком ~Rx на верхней панели моста Р-38.
2. Включают реохордный мост в сеть. Загорается сигнальная лампочка.
3. Переключатель питания ставят в нулевое положение, а переключатель пределов измерения в положение «установка нуля».
4. Переключатель гальванометра переводят в положение «грубо». Осторожным вращение корректора устанавливают стрелку гальванометра на нуль. После этого переключают гальванометр в положение «точно» и производят измерение сопротивления раствора, находящегося в сосуде, выводя стрелку на нуль. Предварительно подбирают соответствующий предел измерения.
5. После проведения измерения отключают источник питания. Сосуд отсоединяют и промывают дистиллированной водой.
6. Постоянную сосуда рассчитывают по формуле К = Rя×κ(КС1). Величину удельной электропроводности хлорида калия при температуре опыта находят в приложении (таблица 2).
1.4.2. Определение степени и константы диссоциации слабого электролита
Ход работы:
1. Приготовить серию водных растворов любой из имеющихся одноосновных органических кислот (уксусной, бензойной, муравьиной, лимонной и т. д.) с молярными концентрациями 0,1; 0,05; 0,025; 0,0125; 0,00625 моль/л.
2. По описанной в разделе 1.4.1 методике измерить сопротивление указанной серии растворов и результаты занести в таблицу 1.1.
Таблица 1.1. Результаты эксперимента по измерению сопротивления водных растворов органической кислоты
|
№ опыта
|
1
|
2
|
3
|
4
|
5
|
|
Концентрация кислоты, Сэ, моль/л
|
0,1
|
0,05
|
0,025
|
0,0125
|
0,00625
|
|
Сопротивление раствора, R, Ом
|
|
|
|
|
|
|
Удельная электропроводность,
κ = Кя/R, См/см
|
|
|
|
|
|
|
Эквивалентная электропроводность,
λС = κ 1000/Сэ, См см2/моль
|
|
|
|
|
|
|
Степень диссоциации, α = λС/ λ∞ *)
|
|
|
|
|
|
|
Константа диссоциации, К=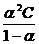
|
|
|
|
|
|
*) λ∞ = λ∞,+ + λ∞,- Значение предельной эквивалентной проводимости найти, пользуясь данными приложения (таблица 1)..
Обработка результатов эксперимента
1. Построить графики зависимости степени диссоциации, удельной и эквивалентной электрической проводимости от концентрации раствора и объяснить ход полученных кривых.
2. Определить из данных опыта экстраполяцией предельную эквивалентную электропроводность слабого электролита. Для этого построить график в координатах κ×103 - 1/λ. Значение λ∞ будет равно отрезку, отсекаемому на оси абсцисс при κ = 0. На оси ординат при С = 0 будет отсекаться отрезок, равный К×λ∞. Зная λ∞, можно рассчитать значение К – константы диссоциации слабого электролита. (Формула 1.3.5).