МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 5 из 16
1.3.5. Найти эквивалентную электрическую проводимость бромида лития, если опытным путем найдено:  (KBr) = 151,9;
(KBr) = 151,9;  (K2SO4) = 153,3;
(K2SO4) = 153,3;  (Li2SO4) = 117,1 См см2/моль.
(Li2SO4) = 117,1 См см2/моль.
1.3.6. Предельная эквивалентная электропроводность ацетата аммония при 25С  (CH3COONH4) = 114,4 См см2/моль. Найдите эквивалентную электропроводность уксусной кислоты при бесконечном разбавлении, если
(CH3COONH4) = 114,4 См см2/моль. Найдите эквивалентную электропроводность уксусной кислоты при бесконечном разбавлении, если  (NH4+) = 73,7;
(NH4+) = 73,7;  (H+) = 349,8 См см2/моль.
(H+) = 349,8 См см2/моль.
1.3.3. Определение растворимости и произведения растворимости малорастворимых соединений
Для малорастворимых соединений между ионами в растворе и твердыми кристаллами устанавливается динамическое равновесие:
Amn+Bnm-(тв.) ↔ mAn+(водн.) + nBm-(водн.).
Константа, характеризующая этот равновесный процесс при данной температуре, носит название произведения растворимости (KSO):
KSO=[An+]m [Bm]n. Так как концентрация ионов в растворе ничтожно мала, можно считать, что коэффициент электропроводности fλ равен единице, тогда λС= λ∞. По закону Кольрауша λ∞ = λК+ + λА-, следовательно, эту величину легко рассчитать, воспользовавшись справочными данными (Приложение). Эквивалентная и удельная электрические проводимости связаны между собой соотношением (1.2.1): 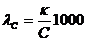 , из которого легко найти эквивалентную или молярную концентрацию раствора, а также рассчитать произведение растворимости.
, из которого легко найти эквивалентную или молярную концентрацию раствора, а также рассчитать произведение растворимости.
Пример 4. Удельная электропроводность раствора бромида серебра κ= 1,576×10-6 См/см, а воды, в которой растворена соль, 1, 519×10-6 См/см при 18оС. Найдите произведение растворимости бромида серебра.
Решение: Увеличение электропроводности раствора по сравнению с чистой водой обусловлено появлением в ней катионов серебра и бромид-анионов., поэтому κ(AgBr) = κ(AgBr×aq) – κ(H2O).
κ(AgBr) = (1,567 – 1,519) × 10-6 = 5,7 ×10-8 См/см.
Из таблицы подвижности ионов (Приложение) находим: λ∞(Ag+) =53,2; λ∞(Br-) = 68,2 См см2/моль.
λ∞(AgBr) = λ∞(Ag+) + λ∞(Br-) = 53,2 + 68,2 = 121,4 См см2/моль.
СЭ= 5,7×10-8×10-3/1,214×102 = 4,7×10-7 моль/л. KSO(AgBr) = [Ag+][Br-].
KSO= (4,7×10-7)2 = 2,21×10-13.
Задачи для самоподготовки
1.3.7. При 18оС удельная электрическая проводимость йодида серебра равна 4,144×10-8См/см, а удельная электрическая проводимость предельно чистой воды, перегнанной в вакууме, определенная в тех же условиях равна 4×10-8См/см. Вычислите произведение растворимости соли.
1.3.8. При 18оС удельная электрическая проводимость сульфата бария
2,623×10-6 См/см, а предельно чистой воды 4,00×10-8 См/см. Найдите концентрацию соли в насыщенном растворе и произведение растворимости.
1.3.4. Кондуктометрическое титрование
Метод измерения электропроводности нашел применение в объемном анализе под названием «кондуктометрическое титрование». Он широко используется при исследовании мутных и окрашенных растворов, которые невозможно титровать с применением обычных индикаторов. Метод успешно применяется в тех случаях, когда между анализируемым и титрующим растворами протекают реакции ионного обмене или окислительно-восстановительные реакции, в результате которых проводящая способность растворов изменяется. Причиной изменения электропроводности может быть:
*образование малодиссоциированных соединений (реакция нейтрализации);
*выпадение в осадок труднорастворимых соединений (реакции осаждения);
*замена более подвижных ионов менее подвижными и наоборот.
Так как подвижности разных ионов отличаются друг от друга, в точке эквивалентности на прямой титрования (см. график, рис. 1.3.1) наблюдается заметный излом.
Пример 5. Поясните сущность кондуктометрического титрования на примерах реакции нейтрализации едким натром: а) соляной кислоты; б) уксусной кислоты; в) смеси этих кислот.
Решение. А) на рис. 1.2. представлен ход кривых основно-кислотного титрования.
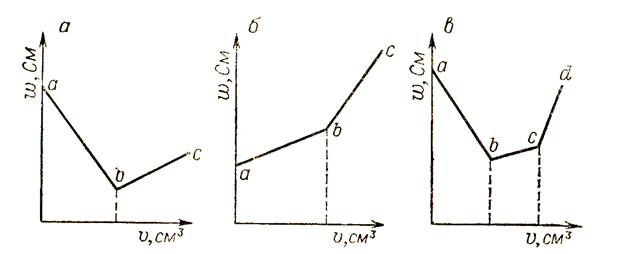
Рис. 1.2. Кривые кондуктометрического титрования кислота + основание.
А) сильная кислота + сильное основание:
H+ + Cl - + Na+ + OH - = Na+ + Cl - + H2O
λ∞(HCl) = 378,3; λ∞(NaCl) = 217,3 См см2/моль.