МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 14 из 16
В этих приборах в качестве эталонного электрода сравнения, как правило, используется каломельный электрод 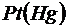 |
|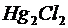 ,
, 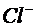 , АQ, а в качестве индикаторного – стеклянный (стеклянная мембрана с водородной функцией).
, АQ, а в качестве индикаторного – стеклянный (стеклянная мембрана с водородной функцией).
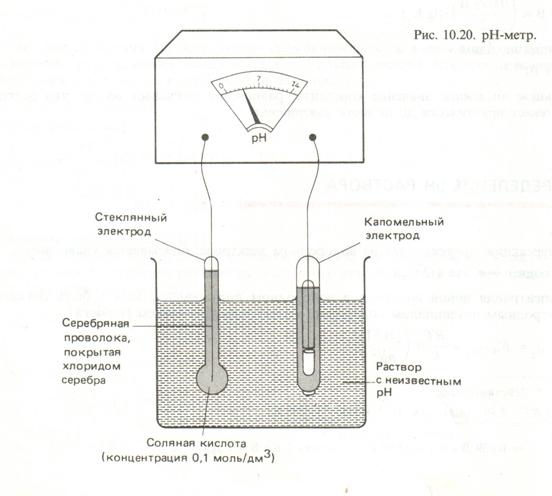
Рис. 2.3. Устройство рН – метра.
Опыт 2.1. Измерение рН растворов
Ход работы:
1. Составить гальванический элемент из стеклянного электрода, опущенного в исследуемый раствор и каломельного электрода сравнения, входящего в комплект РН-метра.
2. Проверить настройку рН-метра, для чего определить значения рН заданных буферных растворов.
3. Определить величину рН контрольного раствора, выданного преподавателем. Рассчитать концентрацию водородных ионов.
Внимание! После каждого определения электроды промывать дистиллированной водой и промокать бумажным фильтром.
Опыт 2.2. Изучение буферных систем
Ход работы:
1. Приготовить 20 мл ацетатного буфера с заданным значением рН (указывается преподавателем) из 0,1 М раствора уксусной кислоты и 0,1 М раствора ацетата натрия. Кк= 1,8 10-5.
2. С помощью рН-метра проверить правильность проведенных расчетов.
Опыт 2.3. Влияние разбавления на рН буферной смеси
Ход работы:
1. Налить в колбочку 10 мл приготовленного в опыте 2.2. буферного раствора.
2. Постепенно разбавлять раствор, прибавляя 5 раз по 1 мл воды. При помощи РН-метра каждый раз определить рН разбавленных растворов.
3. Сравнить полученные результаты с исходным значением РН. Объяснить полученные результаты.
Опыт 2.4. Изучение свойств буферных растворов
1. Налить в 3 пробирки по 2 мл ацетатного буфера (Опыт 2.2).
2. Налить в другие 3 пробирки по 2 мл дистиллированной воды.
3. а) добавить в 2 пробирки первой пары по 3 капли 0,1 н HCl;
б) добавить в 2 пробирки второй пары по 3 капли 0,1 н NaOH;
в) в 2 оставшиеся пробирки третьей пары добавить по 2 капли воды.
4. В каждой пробирке измерить РН. Объяснить наблюдаемые явления.
2.3.3. Потенциометрическое титрование
Химические источники тока могут быть собраны как устройства для титрования и служить для определения концентрации окисляемых или восстанавливаемых веществ. Одно из таких веществ (титрант) добавляется из бюретки к другому веществу, находящемуся в стакане. После каждого добавления титранта измеряют ЭДС гальванического элемента с помощью вольтметра. При проведении кислотно – основного титрования можно воспользоваться рН-метром. Такой способ титрования называется потенциометрическим титрованием. Он может использоваться для проведения окислительно-восстановительного, осадительного или кислотно-основного титрования.
1) Для окислительно-восстановительного титрования в качестве детектирующего электрода используется инертный металлический электрод, в качестве электрода сравнения – каломельный электрод. На рис. 2.4 схематически изображено потенциометрическое титрование Fe2+ церием (1У) Се4+.
Рис. 2.4. Потенциометрическое титрование. а) титрование ионов Fe2+ ионами Се4+; б) типичная кривая потенциометрического титрования.
Точка эквивалентности потенциометрического титрования соответствует положению очень сильного (почти вертикального) подъема кривой титрования (рис. 2.4 б).
2) Для Осадительного титрования используется ионоселективный электрод в сочетании с каким-либо электродом сравнения. Например, для титрования хлорида калия нитратом серебра применяют серебряный электрод, селективный к ионам серебра.
3) Для Кислотно - основного титрования используется стеклянный электрод в сочетании с каломельным. Показания прибора считываются в единицах шкалы рН.
Опыт 2.5. Кислотно - основное потенциометрическое титрование