МЕТОДИЧЕСКИЕ УКАЗАНИЯ К выполнению лабораторно-практических занятий и самостоятельных работ по дисциплине «Физическая и коллоидная химия» по теме Электрохимические методы исследования растворов электролитов
Страница 11 из 16
Титрование. Оно используется для окислительно – восстановительного, осадительного и кислотно–основного титрования. В окислительно - восстановительном титровании в качестве электрода сравнения используется каломельный, а в качестве детекторного – инертный металлический электроды. В осадительном титровании используется ионоселективный электрод в сочетании с электродом сравнения. В кислотно–основном титровании применяют стеклянный электрод (детектор) в сочетании с каломельным.
Упражнение №6. Раствор нитрата серебра потенциометрически титруют 0,1Н раствором хлорида калия. Найдите массу ионов серебра в растворе (мг)
V(KCl),мл 0 1 3 4 5 6 7 8 9 10 11
Е, мВ 432 426 423 414 406 382 181 128 106 97 91
2.2.3. Связь ЭДС с термодинамическими функциями
И потенциалами
Термодинамика подсказывает, что протекание одних реакций возможно, а других – нет. Определение термодинамической возможности протекания окислительно - восстановительных реакций довольно просто выполняется путем сравнения электродных потенциалов двух реакций. Для этого необходимо воспользоваться электрохимическим рядом напряжений, определив окислитель и восстановитель. При конкретных условиях реакция может оказаться термодинамически возможной, но кинетически неосуществимой, так может начаться только после преодоления некоторого энергетического барьера. Для самопроизвольного протекания реакции она должна характеризоваться Отрицательной величиной энергии Гиббса.
Электрохимические системы подчиняются основной термодинамической зависимости, связывающей энтальпию, энтропию и энергию Гиббса:
ΔG = ΔH – TΔS (1).
В гальванических элементах окислительно-восстановительные реакции протекают в растворах электролитов при комнатной температуре и атмосферном давлении, следовательно, изменение энтропии невелико:|ΔH| >> |TΔS|. В таком случае можно принять, что ΔG ≈ ΔH.
Уравнение Вант-Гоффа связывает величину изобарно-изотермического потенциала с константой равновесия химической реакции:
ΔG0 = - RT ln K (2). (2.2.7)
В то же время константа равновесия окислительно-восстановительной реакции, включающей перенос z электронов, связана с электродвижущей силой химического источника тока E0, в котором она протекает, уравнением Нернста:
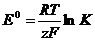 (3). (2.2.8)
(3). (2.2.8)
Сопоставление уравнений (2) и (3) приводит к выражению, связывающему величину энергии Гиббса с величиной ЭДС гальванического элемента:
ΔG0 = - z F E0 (4). (2.2.9)
Если химическая реакция в гальваническом элементе протекает обратимо, то при постоянных температуре и давлении получаемая от нее работа будет максимальной полезной работой химического процесса Амакс.. Эта работа будет равна убыли изобарно-изотермического потенциала:
Амакс.. = -ΔG (2.2.10)
Чтобы связать основные термодинамические характеристики химических реакций, протекающих в гальванических элементах, с величиной ЭДС, необходимо обратиться к термодинамике, где доказывается, что
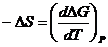 (2.2.11)
(2.2.11)
Тогда основная термодинамическая зависимость будет выглядеть следующим образом:
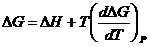 (2.2.12).
(2.2.12).
Изменение изобарно-изотермического потенциала в зависимости от ЭДС:
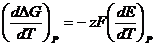 (2.2.13).
(2.2.13).
Объединяя два последних уравнения, получим:
 (2.2.14).
(2.2.14).
Подстановка (7) в уравнение (5) дает связь ЭДС с изменением энтропии:
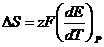 (2.2.15).
(2.2.15).
Упражнение № 7. При 25оС и постоянном давлении определите максимальную работу химической реакции
Zn + CdSO4 = ZnSO4 = Cd,
Oбратимо протекающей в гальваническом элементе