МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ к лабораторной работе по физической химии ПРИМЕНЕНИЕ МЕТОДОВ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА В ХИМИЧЕСКОЙ КИНЕТИКЕ
Страница 6 из 11
Фотометрическое измерение применимо для исследования скорости химических реакций в тех случаях, когда исходное вещество окрашено иначе, чем смесь продуктов реакции.
Так распад комплексного иона  , окрашенного в коричневый цвет, протекает по уравнению:
, окрашенного в коричневый цвет, протекает по уравнению:
 g
g 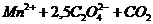 .
.
Продукты распада бесцветны.
Механизм сложен, но зависимость скорости реакции от времени подчиняется уравнению первого порядка.
Оптическая плотность окрашенного раствора пропорциональна концентрации, поэтому константу скорости при данной температуре можно рассчитать по уравнению:
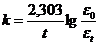 ,
,
Где 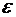 - оптическая плотность раствора в начальный момент и в момент времени
- оптическая плотность раствора в начальный момент и в момент времени 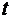 .
.
Цель работы: Определить порядок реакции, константу скорости, период полураспада и энергию активации разложения комплексного иона триоксалата марганца.
Исходные растворы: 0,01 М  ;
;
0,1 М 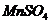 ;
;
0,1 М 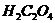 .
.
Измерение оптической плотности ведется на колориметре фотоэлектронном КФК-2 с синим светофильтром.
Методика измерений по инструкции к прибору.
Ход работы.
1. Приготовить прибор.
2. Смешать растворы 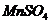 и
и 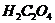 в соотношении 1 : 7.
в соотношении 1 : 7.
3. Прибавить к 4-м частям бесцветной смеси одну часть раствора  . Быстро образуется коричневая комплексная соль.
. Быстро образуется коричневая комплексная соль.
4. Поместить комплексную соль в 10 мм кювету и начать измерения.
За начало опыта принять первое измерение (включить секундомер). Измерять через 1, 2 и 4 мин. Закончить измерения, когда оптическая плотность снизится до 0,1.
Во избежание нагрева раствора держать закрытыми шторки на пути лучей между измерениями.
Результаты оформить в виде таблицы.
Построить график в координатах 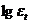 – T.
– T.
Повторить опыт при T + 10°, или T - 10° и рассчитать энергию активации (см. предыдущую работу).
3. Кондуктометрический метод изучения кинетики взаимодействия этилацетата с гидроксильными ионами.
3.1 Теоретические основы.
Омыление этилацетата в щелочных водных растворах протекает по уравнению
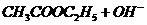 ž
ž 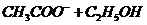
Реакция протекает с измеримой скоростью при обычной температуре и может быть изучена методом измерения электропроводности раствора.
В начале реакции проводниками электрического тока являются ионы 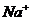 и
и 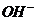 , а по окончании – ионы
, а по окончании – ионы 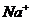 и
и 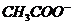 , т. е. более подвижные ионы
, т. е. более подвижные ионы 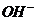 заменяются менее подвижными
заменяются менее подвижными 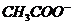 сопротивление
сопротивление  раствора растет.
раствора растет.